Cheratocono
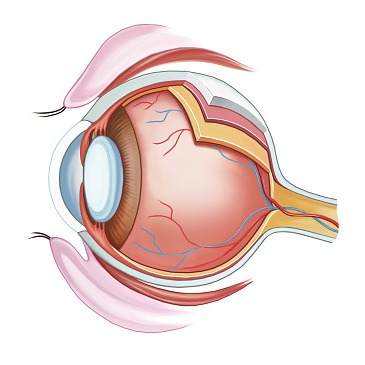
La cornea è la parte più anteriore e trasparente dell’occhio, rappresentando il primo mezzo diottrico che la luce attraversa, entrando dentro al nostro occhio. Si può paragonare al vetro del quadrante dell’orologio, perché è convessa anteriormente e concava posteriormente. Il suo spessore è minore nella porzione centrale e maggiore nella porzione periferica. Dietro la cornea, possiamo vedere l’iride, la parte colorata dell’occhio, e al centro la pupilla, il piccolo foro rotondo nero.
La parola cheratocono deriva dal greco, e si compone delle parole “keras”, che vuol dire cornea, e “conus”, con cui si intende la forma conica protrudente, che assume la cornea nelle fasi più avanzate della malattia. Il cheratocono è una patologia degenerativa, che conduce ad una progressiva deformazione corneale con assottigliamento del suo spessore, in particolare centrale e paracentrale, e comparsa di astigmatismo irregolare, che determina una riduzione della capacità visiva.
Tradizionalmente, il cheratocono viene definito come “non infiammatorio”, ma, in realtà, molti studi hanno attestato frequente associazione con aumento dei mediatori dell’infiammazione, indicando che gli occhi con cheratocono sono spesso anche infiammati.
Sebbene sia una condizione bilaterale, ovvero siano interessati entrambi gli occhi, di solito il quadro clinico, in un occhio, è più severo che nel controlaterale. Per questo, il quadro clinico viene definito “asimmetrico” nella sua evoluzione. Ha un andamento progressivo che comporta una modifica dei principali assi corneali, con peggioramento più o meno veloce della vista.
Colpisce tutte le etnie, con una prevalenza più elevata in Asia e in Medio Oriente. Riguarda entrambi i sessi: in passato, era stata documentata una maggiore ricorrenza nel sesso maschile, che però è stata poi smentita da alcuni studi successivi, che hanno dimostrato che non esistono differenze significative tra maschi e femmine.
Approfondimenti
 Cause
Cause
Esiste una predisposizione genetica, ma solo il 15% delle persone affette ha un parente con cheratocono. Al contrario, chi ha un parente con diagnosi nota di cheratocono ha un rischio di andare incontro alla malattia da 15 a 67 volte più alto, rispetto al resto della popolazione.
L’allergia e l’atopia, con più elevati livelli di IgE, sono state recentemente associate ad un maggior rischio di sviluppare cheratocono. Altri fattori predisponenti sembrerebbero essere lo strofinio assiduo dell’occhio e i microtraumatismi continui indotti dalle lenti a contatto.
In base alla genetica, alcuni individui avrebbero degli squilibri nell’attività di alcuni enzimi, che agiscono a livello della cornea, che porterebbero ad un'alterazione nei legami crociati delle fibre di collagene, con conseguente diminuzione della rigidità corneale. Il cheratocono, nella maggior parte dei casi, si manifesta in forma isolata, ovvero non si associa ad altre patologie. Tuttavia, in alcuni casi, lo si può riscontrare in persone già affette da malattie geneticamente determinate, quali la Sindrome di Ehlers-Danlos, la sindrome di Marfan, la sindrome della sclera blu, che comportano anomalie del collagene in vari distretti corporei.
È stata documentata anche la sua frequente presenza in concomitanza ad altre sindromi genetiche, quali: la sindrome di Down, la Sindrome di Alport, la Sindrome di Crouzon, l’amaurosi congenita di Leber, la Sindrome di Noonan, etc.
 Sintomi
Sintomi
In rari casi, il cheratocono può comparire già nella tarda infanzia; più spesso, insorge nell’adolescenza e può peggiorare fino a circa 40 anni di età, quando si assiste ad una stabilizzazione del quadro clinico.
Negli stadi iniziali, la malattia può passare inosservata perché si parla di forme asintomatiche. Le forme fruste sono più facilmente individuabili, se l’occhio controlaterale ha già un cheratocono in stadio più evoluto.
Una delle prime manifestazioni, durante la pubertà, può essere la comparsa di un astigmatismo, un difetto visivo che comporta una visione sfocata, sia da vicino che da lontano, con deformazione più o meno accentuata delle immagini che appaiono schiacciate, con margini sbavati. Si avranno, inoltre, aloni attorno alle luci in condizioni di scarsa illuminazione, per esempio di notte. L’astigmatismo legato al cheratocono è più spesso un astigmatismo miopico, ovvero col segno meno, che precede il valore assoluto, ad assi irregolari, che diventa via via sempre più difficile correggere con occhiali e necessita di lenti a contatto, rigide o semirigide, per una migliore correzione.
Può aumentare la sensibilità alla luce, con fotofobia e necessità di sfregare gli occhi, lo sfregamento però potrebbe favorire il peggioramento del cheratocono.
Il cono può essere posizionato in qualsiasi porzione della cornea, anche se è più frequentemente collocato nella parte inferiore. La posizione del cono influenza l'acuità visiva, infatti coni che si trovano al centro danno alterazioni della vista più marcate rispetto a coni collocati nella parte inferiore.
 Diagnosi
Diagnosi
Alcuni segni del cheratocono sono individuabili già durante la visita oculistica. Con la retinoscopia si nota un riflesso a forbice.
Con l’oftalmoscopio diretto, il riflesso che appare è tipico, in quanto è dovuto alla curvatura irregolare della cornea più sottile all’apice, e viene definito a goccia d’olio, poiché si crea un’ombra rotonda in media periferia.
Con la lampada a fessura, in circa l’86% dei casi, almeno in un occhio, si riscontra un anello di Kaiser Fleisher, ovvero un anello giallo-brunastro o verdastro, formato dai depositi del ferro contenuto nella lacrima, che si accumula intorno alla base del cono. Nelle forme di cheratocono più avanzate, con la lampada a fessura è possibile visualizzare, nel 65% dei casi, delle strie di Vogt, piccole strisce verticali parallele, che si creano per lo sfiancamento della cornea e scompaiono solo mentre si preme delicatamente l'occhio con un dito.
Le strie di Vogt vanno in diagnosi differenziale con le strie di Haab, che si riscontrano nel glaucoma congenito ed hanno andamento orizzontale, non verticale. Inoltre, nelle forme della malattia in cui il cono è più pronunciato si ha il segno di Munson, ovvero una forma a V della palpebra inferiore, nello sguardo verso il basso, e il segno di Rizzuti, ovvero un riflesso brillante nel settore nasale vicino al limbus, quando una luce è proiettata nell’area temporale al limbus.
L’astigmatismo determinato dal cheratocono può essere evidenziato tramite:
- autorefrattometria: si tratta di un esame semplice e non invasivo. Da seduti, si appoggiano mento e fronte su appositi supporti e si fissa un’immagine centrale che si sfoca. L’auto-refrattometro permette di eseguire una valutazione computerizzata accurata relativa al difetto visivo, che andrà poi integrata dall’esperienza dell’oculista e dalla percezione soggettiva del paziente;
- topografia corneale: si tratta di un esame veloce, non invasivo e indolore, che permette di conseguire una vera e propria mappa della curvatura della cornea, la parte più anteriore e trasparente dell’occhio. Al paziente, è richiesto di sedersi, appoggiando il mento e la fronte su specifici supporti. A questo punto, bisognerà fissare una mira luminosa, localizzata al centro di una serie di anelli concentrici, che vengono proiettati sulla cornea. In base ai risultati della mappa colorimetrica che ne risulta, si otterranno punti di maggiore curvatura della cornea, contraddistinti da colori caldi, come il rosso e l'arancione, e punti di minore curvatura, contrassegnati da colori freddi, come il blu e il verde. Ovviamente, oltre ai dati colorimetrici, sono molto importanti i valori numerici che si ottengono, che vanno valutati dall’oculista. Nel caso di applicazione di lenti a contatto, astigmatismi elevati o irregolari, trapianti di cornea, la topografia è assolutamente indispensabile.
- le forme di cheratocono lievi sono quelle con K in ogni punto della mappa topografica inferiore a 45D;
- le forme moderate hanno un k compreso tra 46 e 52 D;
- le forme avanzate hanno un k compreso tra 53 e 59 D;
- le forme severe hanno un K che supera 59 D.
Il cheratocono avanzato ha una colorazione più omogenea nella mappa, a causa di un innalzamento complessivo della cornea.
La misurazione dello spessore della cornea, tramite pachimetro, nel cheratocono, permette di valutare anche il grado di sfiancamento della cornea all’apice. Secondo la classificazione che prevede la misurazione dello spessore corneale all'apice, si distingue:
- uno stadio subclinico, con spessore apicale> 500 micron;
- un primo stadio, con spessore compreso tra 500 e 450 micron;
- un secondo stadio, in cui lo spessore varia tra 450 e 400 micron;
- un terzo stadio, che va da 400 a 360, un quarto che comprende i valori tra 360 e 320;
- un quinto stadio o fase cicatriziale, in cui lo spessore apicale è ridotto al di sotto dei 320 micron.
La tomografia corneale è un esame che si esegue con le stesse modalità della topografia, cioè ci si siede e, poggiando mento e fronte, si fissa una mira centrale. Anche in questo caso, quindi, è di facile e rapida esecuzione e non invasivo. Permette una misurazione globale della cornea: curvatura della faccia anteriore, curvatura della faccia posteriore, spessore corneale e profondità della camera anteriore dell’occhio. La cheratometria con Oftalmometro di Javal, invece, consente di valutare solo la curvatura anteriore della cornea. Si esegue con uno strumento che esiste già dal 1800, ma che resta comunque semplice e valido.
Esistono patologie della cornea, inoltre, che vanno in diagnosi differenziale con il cheratocono:
- degenerazione marginale pellucida;
- cheratoglobo;
- megalocornea;
- cheratocono posteriore;
- degenerazione marginale di Terrien.
 Rischi
Rischi
Chi è affetto da cheratocono deve sottoporsi a visite oculistiche di controllo e topografie corneali con cadenza regolare. Può andare, infatti, incontro a frequenti cambiamenti della vista, che necessitano altrettanto frequenti variazioni della correzione, con occhiali o lenti a contatto.
La qualità della vita peggiora quando, nonostante la migliore correzione con lenti possibile, la capacità visiva resta scarsa. In questi casi, sarà necessario ricorrere al trattamento chirurgico.
Nei casi più avanzati, inoltre, può subentrare un assottigliamento tale dello spessore, all’apice della cornea, da andare incontro ad un idrope corneale, ovvero si può venire a creare una soluzione di continuità della Descemet (uno degli strati più interni della cornea), in corrispondenza dell’area maggiormente sfiancata.
Quando si risolve, l'idrope causa la formazione di una cicatrice, che può ridurre la vista più o meno gravemente, a seconda dell'estensione e della collocazione. Questa evenienza spesso richiede il ricorso all’intervento chirurgico per sostituire la cornea, resa opaca dai fenomeni di cicatrizzazione, con una cornea trasparente.
 Cure e Trattamenti
Cure e Trattamenti
Iniziare un follow up, e sottoporsi ad un eventuale trattamento precocemente, garantisce un migliore risultato in termini visivi. Dunque, è importante fare diagnosi ed essere consapevoli dell’esistenza della malattia.
Se, fino a qualche decennio fa, l’unica alternativa per migliorare la qualità della visione era l’utilizzo delle lenti a contatto rigide o semirigide, per far diminuire i fenomeni di aberrazione legati all’acquisizione della cornea della forma a “cono”, attualmente esistono molte più soluzioni e trattamenti.
In alcuni casi, si utilizza ancora la lente a contatto semirigida con risparmio apicale, che permette di utilizzare la lente più tempo e riduce il rischio di formazione di abrasioni corneali, perché, all’apice, mantiene una certa distanza dalla cornea. Ciò garantisce un’abbondante frapposizione di liquido lacrimale tra la lente a contatto e la cornea stessa. Questo, per il paziente, rappresenta anche un maggior comfort di indosso.
In altri casi, si possono utilizzare i “piggyback systems”, ovvero delle lenti a contatto rigide, che vengono indossate sopra lenti a contatto morbide. In questi sistemi, le lenti a contatto morbide servono a migliorare la sensazione di confort; invece, le lenti a contatto rigide garantiscono la stabilità e la centratura della lente.
In alternativa, le lenti a contatto corneo-sclerali e sclerali hanno una più ampia base di appoggio rispetto alle altre, e anche una più ampia zona ottica. Sono usate soprattutto in caso di coni collocati inferiormente, che non vengono corretti bene dalle lenti a contatto rigide o da sistemi “piggyback”. Garantiscono un’ottima stabilità e centratura.
Le lenti a contatto ibride sono, invece, quelle lenti che hanno una porzione centrale, costituita da una piccola parte rigida, gas permeabile e una più estesa porzione periferica, formata da una lente morbida, che permette un confortevole appoggio sulla sclera.
Il trattamento gold standard, per le forme di cheratocono non troppo severe ma che mostrano un’evolutività, è rappresentato dal cross-linking. Questa procedura prevede il realizzarsi di una reazione di natura chimico-fisica, che miri a ridurre l’ectasia della superficie posteriore del cono e, dunque, anche l’elevazione posteriore. Si fa assorbire alla cornea una certa quantità di vitamina B2 o riboflavina, posta in soluzione di destrano al 20%. Il destrano nella soluzione serve a bilanciarla, regolandone l’osmolarità, per evitare che, a seguito dell’applicazione sull’ occhio del liquido, la cornea possa rigonfiarsi, a causa di un'osmolarità eccessiva della soluzione. Poi si espone la cornea a irraggiamento con UVA. Questi raggi hanno lunghezza d’onda di 370 nanometri e l'esposizione dura circa 5 minuti. Gli UVA servono ad attivare la riboflavina, portando alla formazione di legami covalenti tra le fibrille di collagene.
Esistono due tipi di cross-linking:
- il primo tipo (Epi-off) prevede una disepitelizzazione dei 6-7 mm centrali della cornea, che venga effettuata preliminarmente alla procedura, per permettere una maggiore penetrazione del principio attivo applicato (la riboflavina in soluzione di destrano). Questa prima metodica viene chiamata Epi-off, appunto, perché, in questo caso, l’epitelio viene asportato;
- il secondo tipo (Epi-on) utilizza una corrente elettrica continua a bassa intensità, fatta agire per 5 minuti, che consenta comunque una sufficiente penetrazione della riboflavina, senza la preliminare rimozione dell’epitelio corneale superficiale. Per questo, tale metodica viene definita Epi-on. La quantità di riboflavina impiegata nella procedura Epi-on è la metà di quella somministrata nella procedura Epi-off. Questo grazie al fatto che la sua diffusione risulta ottimale su tutta la cornea, in quanto la iontoforesi permette al principio attivo di venire assorbito dai tessuti, seguendo il flusso di corrente elettrica e, quindi, attraversando l’epitelio integro. Viene applicato un elettrodo negativo sulla cornea e un elettrodo positivo sulla fronte del paziente. Ad assorbimento della riboflavina avvenuto, la cornea viene sottoposta ad irraggiamento con UVA per 5 minuti (irradiazione UV-A a 10 mW/cm2). La reazione infiammatoria conseguente è minima e non ci sono opacità corneali residue dopo il trattamento.
Il cross- linking è una procedura assolutamente ripetibile nel tempo. Mira ad indurre la formazione di nuovi ponti tra le fibrille collagene, che compongono le lamelle per infittire la trama di sostegno dello stroma corneale, rinforzando come risultato la cornea stessa. Può essere fatto su un solo occhio alla volta (mai su entrambi simultaneamente).
Il cross-linking può essere eseguito, e viene rimborsato dal Sistema Sanitario Nazionale, solo se:
- l’età del soggetto trattato è superiore agli 8 anni;
- la vista con la migliore correzione possibile (con occhiali o lenti a contatto) non è inferiore a 5/10 in quell’occhio;
- l’utilizzo di lenti a contatto è stato sospeso da almeno quattro settimane prima degli accertamenti preoperatori;
- si hanno delle foto del segmento anteriore che attestino lo stato della cornea prima del trattamento;
- la conta delle cellule della parte più interna della cornea, ovvero l’endotelio, risulta superiore a 2000;
- è stata fatta una pachimetria corneale che documenta valori di spessore corneale non inferiori a 450 micron nel punto più sottile, oppure c’è una diagnosi di malattia geneticamente determinata che porta a sfiancamento corneale con spessore della cornea non inferiore a 400 micron (con spessori inferiori a 400 micron porterebbe ad una reazione tossica nell’endotelio);
- la curvatura corneale massima sulla mappa topografica in algoritmo istantaneo è inferiore a 55D;
- sono state fatte almeno 2 topografie a distanza di circa due mesi l’una dall’altra, sempre con lo stesso strumento, prima di iniziare il trattamento, che attestino il peggioramento della malattia.
Sono invece cause di esclusione dal trattamento:
- stato di gravidanza;
- presenza di opacità corneali;
- infezioni oculari in atto;
- infiammazioni della cornea in atto;
- sindrome da occhio secco severa;
- presenza di poche cellule staminali al limbus, poiché è proprio grazie alle cellule staminali che viene garantito il mantenimento della trasparenza della cornea stessa;
- cheratiti (ovvero infezioni della cornea) da virus dell’herpes pregresse o in atto;
- pregresso idrope corneale che ha lasciato importanti cicatrici sulla cornea;
- precedenti interventi chirurgici sulla cornea.
Un'altra terapia chirurgica per il cheratocono prevede l'utilizzo di anelli intrastromali corneali di Ferrara, per appiattire la cornea e ridurre lo sfiancamento del cono. Vengono applicati dopo l'anestesia locale. Si possono impiantare anche con l'ausilio del laser a femtosecondi. Il paziente può tornare a lavoro già il giorno dopo l’intervento. L’impianto degli anelli di polimetacrilato può essere associato al cross -linking per ridurre le aberrazioni.
Il ring da 340 gradi, anello quasi completo, tranne nei 20 gradi che servono a inserirlo, è utile nel caso di cheratoconi a capezzolo. Nei casi di cheratocono più evoluti, quando la vista è inferiore a 5/10 e lo sfiancamento del cono è eccessivo per procedere al cross-linking o all’impianto di anelli intrastromali, si ricorre al trapianto di cornea.
La tipologia classica di trapianto, utilizzata in caso di cheratocono, è la cheratoplastica perforante, ovvero un trapianto a tutto spessore della cornea opacata con una cornea trasparente proveniente dalla banca degli occhi. In questo caso, il follow up postoperatorio deve prevedere visite oculistiche frequenti e deve essere prolungato del tempo. Durante la fase di follow up, si applicano colliri a base di cortisone, che servono ad evitare il rigetto del lembo trapiantato, e per questo devono essere usati a lungo.
Un’altra tipologia di trapianto corneale che può essere utilizzata è la DALK, che prevede il trapianto della parte anteriore e intermedia della cornea, con la sostituzione dello stroma corneale del ricevente con lo stroma corneale del donatore, mantenendo, però, l’endotelio corneale e la limitante posteriore originari, ovvero non sostituendo la porzione più interna della cornea. Questa tecnica preserva l'integrità oculare ed ha un minor rischio di rigetto della cornea donata. Non sempre, tuttavia, è applicabile, poiché con il trapianto a tutto spessore, ovvero con la cheratoplastica perforante, spesso si ottengono dei risultati migliori in termini di recupero visivo.
Bibliografia
- Gharieb HM, Othman IS, Oreaba AH, Abdelatif MK. Topographic, elevation, and keratoconus indices for diagnosis of keratoconus by a combined Placido and Scheimpflug topography system. Eur J Ophthalmol 2021;31:1553–62.
- Zotta PG, Moschou KA, Diakonis VF, Kymionis GD, Almaliotis DD, Karamitsos AP, et al. Corneal collagen cross-linking for progressive keratoconus in pediatric patients: a feasibility study. J Refract Surg 2012;28.
- Gordon-Shaag A, Millodot M, Shneor E, Liu Y. The genetic and environmental factors for keratoconus. Biomed Res Int 2015;2015.
- Pin ero DP, Alio ́ JL, Aleson A, Vergara ME, Miranda M. Corneal volume, pachymetry, and correlation of anterior and posterior corneal shape in subclinical and different stages of clinical keratoconus. J Cataract Refract Surg 2010;36: 814–25.
- Jones-Jordan LA, Walline JJ, Sinnott LT, Kymes SM, Zadnik K. Asymmetry in keratoconus and vision-related quality of life. Cornea 2013;32:267–72.
- Valdez-García JE, Sepúlveda R, Salazar-Martínez JJ, Lozano-Ramírez JF. Prevalence of keratoconus in an adolescent population. Rev Mex Oftalmol 2014; 88:95–8.
- Naderan M, Jahanrad A, Balali S. Histopathologic findings of keratoconus corneas underwent penetrating keratoplasty according to topographic measurements and keratoconus severity. Int J Ophthalmol 2017;10:1640–6.
- Nichols JJ, Steger-May K, Edrington TB, Zadnik K. The relation between disease asymmetry and severity in keratoconus. Br J Ophthalmol 2004;88:788–91.
- Galvis V, Sherwin T, Tello A, Merayo J, Barrera R, Acera A. Keratoconus: an inflammatory disorder? Eye 2015;29:843–59.
- Brierly SC, Izquierdo L, Mannis MJ. Penetrating keratoplasty for keratoconus. Cornea 2000;19:329–32
- Keane M, Coster D, Ziaei M, Williams K. Deep anterior lamellar keratoplasty versus penetrating keratoplasty for treating keratoconus. Cochrane Database Syst Rev 2014:CD009700.
- Gore DM, Leucci MT, Anand V, Fernandez-Vega Cueto L, Arba Mosquera S, Allan BD. Combined wavefront-guided transepithelial photorefractive keratectomy and corneal crosslinking for visual rehabilitation in moderate keratoconus. J Cataract Refract Surg 2018;44:571–80.
- Zare MA, Hashemi H, Salari MR. Intracorneal ring segment implantation for the management of keratoconus: Safety and efficacy. J Cataract Refract Surg 2007;33: 1886–91.
- Mandathara PS, Kalaiselvan P, Rathi VM, Murthy SI, Taneja M, Sangwan VS. Contact lens fitting after corneal collagen cross-linking. Oman J Ophthalmol 2019;12:177–80.
- Vincent SJ, Fadel D. Optical considerations for scleral contact lenses: A review. Cont Lens Anterior Eye 2019;42:598–613.
- Romero-Jimenez M, Santodomingo-Rubido J, Wolffsohn JS. Keratoconus: a review. Cont Lens Anterior Eye 2010;33:157–66.
- Zadnik K, Barr JT, Gordon MO, Edrington TB. Biomicroscopic signs and disease severity in keratoconus. Cornea 1996;15:139–46.
- KennedyRH,BourneWM,DyerJA. A48-yearclinicalandepidemiologicstudyof keratoconus. Am J Ophthalmol 1986;101:267–73. Leggi altro...
L'informazione presente nel sito deve servire a migliorare, e non a sostituire, il rapporto medico-paziente. In caso di disturbi e/o malattie rivolgiti al tuo medico di base o ad uno specialista.
Cerca i migliori specialisti che si occupano di CheratoconoRevisione Scientifica

Trova il Medico più adatto alle tue esigenze.