Cos’è la Leucemia Linfatica Cronica?
La Leucemia Linfatica Cronica (LLC) è la leucemia più diffusa nel mondo occidentale. E’, invece, rara negli asiatici. Essa colpisce prevalentemente i soggetti anziani, con un'età mediana dei pazienti affetti intorno ai 70 anni ed un’ incidenza di circa 5 persone su 100.000 per anno. Tale incidenza aumenta con l'aumentare dell'età. In Italia le stime parlano di circa 1.600 nuovi casi ogni anno tra gli uomini e 1.150 tra le donne. La Leucemia Linfatica Cronica (LLC) è caratterizzata da progressivo accumulo di cellule B mature non funzionanti nel sangue, midollo osseo e nei tessuti linfoidi.
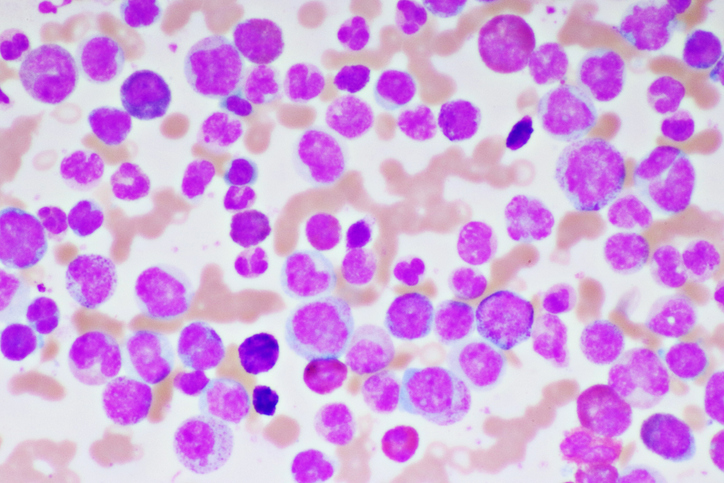
Come si diagnostica?
La diagnosi è stabilita dalla conta ematica, dalla morfologia dello striscio di sangue, e dall’immunofenotipizzazione citofluorimetrica dei linfociti B circolanti, in grado di identificare una popolazione clonale delle cellule B che trasportano l'antigene CD5 così come alcuni marcatori B, quali il CD19 e il CD 23.
Gran parte dei pazienti con la LLC, al momento della diagnosi, sono asintomatici e non hanno bisogno di trattamento. Tuttavia, è necessario, già alla diagnosi, stabilire lo stadio della malattia, l’immunofenotipo in citofluorimetria, l’assetto citogenetico mediante FISH, e la evolutività della malattia con un controllo emocitometrico a 3 e 6 mesi dalla diagnosi, in quanto la malattia è eterogenea e la prognosi è estremamente diversa a seconda dello stadio, dell’assetto citogenetico e di alcuni marker di superficie cellulare, valutabili in citofluorimetria o in biologia molecolare (ZAP 70 e CD38, riarrangiamento delle Immununoglobuline).
Quanti stadi ha la leucemia linfatica cronica?
Esistono due sistemi di stadiazione il metodo di Rai e quello di Binet, molto simili , che sono stabiliti da un esame semplice esame fisico e dalla conta ematica, basati sulla presenza di linfoadenomegalia, splenomegalia, anemia e piastrinopenia. Vari indicatori biologici e genetici hanno anche valore prognostico. Le delezioni del braccio corto del cromosoma 17 (del 17p) prevedono la resistenza alla maggior parte delle terapie disponibili.Come si sviluppa?
Il paziente con Leucemia Linfatica Cronica è spesso un anziano e quindi molte volte presenta delle comorbidità, che possono condizionare il tipo di trattamento della LLC e influire sulla durata e qualità di vita in maniera altrettanto significativa della LLC. Il paziente con LLC, pertanto, da una parte deve essere valutato compiutamente da un Centro Specialistico alla diagnosi ma, successivamente, va seguito compiutamente da un punto di vista internistico.
Come si cura la leucemia linfatica cronica?
Negli ultimi dieci anni, la nostra comprensione della LLC e, di conseguenza, i nostri approcci diagnostici e terapeutici, sono cambiati drammaticamente. L’aggiunta dell’anticorpo monoclonale anti CD20 (Rituximab) alla chemioterapia convenzionale, rappresentata nei giovani (<65-70 aa) dalla associazione Fludarabina+Ciclofosfamide, ha portato ad una migliore risposta in termini di remissione completa e ad una sopravvivenza più lunga. Tuttavia, la sua applicazione deve essere oculata a causa della possibilità di sindromi mielodisplastiche secondarie. Nei pazienti anziani questa terapia è limitata da una sostanziale mielosoppressione con conseguenti infezioni. Pertanto, negli anziani si è continuato ad utilizzare il Chlorabucil (Leukeran) a cui in questi anni è stato aggiunto ugualmente il Rituximab con vantaggi notevoli in termini sia di percentuale di remissione completa, che in termini di sopravvivenza, come dimostrano i recenti dati pubblicati dal nostro gruppo.
La terapia con l’ anticorpo monoclonale anti CD20 (Rituximab)
La terapia mirata con anticorpo monoclonale anti CD20, ha rappresentato il primo reale progresso terapeutico nel trattamento della CLL ed è di particolare valore nelle condizioni autoimmuni associate. Il Rituximab è un anticorpo IgG1 monoclonale di prima generazione di tipo chimerico murino/umano diretto contro CD20, una fosfoproteina glicosilata espressa sulla superficie di tutte le cellule B che iniziano nella fase pro-B. Il Rituximab induce apoptosi diretta nonché citotossicità complemento-dipendente e la citotossicità cellulo-mediata anticorpo-dipendente nelle cellule B neoplastiche.
Il Rituximab, che ha ricevuto l'approvazione della Food and Drug Administration (FDA, Centro di Controllo americano) per il trattamento dei linfomi non-Hodgkin già nel 1997, è stato approvato successivamente per la Leucemia Linfatica Cronica e, in aggiunta alla chemioterapia, solo nel 2009 dall’ EMEA, l’organo di controllo europeo.
In effetti, l'efficacia del Rituximab come agente singolo nella LLC/piccolo linfoma linfocitica (SLL) è stata deludente negli studi iniziali. Questo è dovuto alla scarsa espressione del CD20 sulle cellule di linfatica cronica, che l'uso di dosi più elevate del farmaco ha permesso, almeno in parte, di superare.
Tuttavia, si stanno imponendo immunofarmaci con una maggiore attività nella LLC. Nel 2009, è stato approvato dalla FDA per il trattamento della LLC refrattaria alla fludarabina e alemtuzumab un anticorpo di seconda generazione (completamente umanizzato), Ofatumumab. Questo colpisce un epitopo del CD20 diverso da quello del Rituximab e differentemente espresso dalle cellule della Leucemia Linfatica Cronica.
Inoltre, arriveranno a breve anche nell’uso clinico routinario, gli anticorpi monoclonali anti-CD20 di terza generazione, che, oltre ad essere completamente umanizzati, portano una regione Fc progettata per aumentare il loro legame al recettore FcγRIIIa.
La terapia con l’ Obinutuzumab
L’Obinutuzumab (GA101, Genentech Inc), in una sperimentazione clinica randomizzata, associato al Chlorambucil (Leukeran), ha dimostrato un’ efficacia maggiore del Rituximab nei pazienti in prima diagnosi, e la FDA ha ammesso all’uso clinico routinario l’Obitunuzumab nei pazienti precedentemente non trattati nel Novembre 2013.Secondo i dati presentati nel Dicembre 2013 al Congresso dell’American Society of Hematology, ed ora riportati dal New England Journal of Medicine, nello studio policentrico patrocinato dal Gruppo di Studio Tedesco LLC, nei pazienti naïve affetti da leucemia linfocitica cronica (CLL), l’Obinutuzumab (GA101) più Chlorambucil, rispetto a Rituximab più Chlorambucil, era in grado di prolungare significativamente la sopravvivenza complessiva (Overall Survival) e la sopravvivenza libera da progressione (PFS), con una percentuale di risposta più alta e completa in relazione all’assenza di una malattia minima residua (MRD). Nella sperimentazione CLL11, che ha coinvolto quasi 800 pazienti, sono stati randomizzati 336 pazienti nel gruppo Obinutuzumab/Chlorambucil e 321 in quello Rituximab/Chlorambucil.
L'analisi di fase 2 ha dimostrato un tasso di risposta globale del 78% con Obinutuzumab e il 65% con Rituximab (P < .0001). I tassi di risposta completa era del 21% con Obinutuzumab e il 7% con Rituximab. In ogni gruppo, il 58% dei pazienti ha raggiunto una risposta parziale. La scomparsa della malattia minima residua (MRD) è emersa come indicazione della completezza della risposta e ha implicazioni per la recidiva e la sopravvivenza.
I risultati hanno mostrato che il 19,5% dei pazienti nel braccio Obinutuzumab erano MRD negativa a livello del midollo osseo, contro il 2.6 % del gruppo Rituximab (P < .0001). Un confronto separato di sola chemioterapia versus combinazione Obinutuzumab-Chlorambucil ha mostrato una PFS mediana di 26,7 mesi con la combinazione e 11,1 mesi con la monoterapia. La differenza ha rappresentato una riduzione dell'82% del rischio di progressione a favore della combinazione Obinutuzumab/Chlorambucil (P < .0001). L'analisi della sopravvivenza globale ha mostrato un beneficio significativo dell’Obinutuzumab, rispetto alla sola Chlorambucil dopo un follow-up mediano di 23 mesi con la combinazione e 20 mesi nel gruppo Chlorambucil in monoterapia (p = 0,0022). I dati restano precoci per l'analisi della sopravvivenza nel confronto tra i due regimi di combinazione, anche se, dopo un follow - up di circa 19 mesi, un rapporto di rischio di 0,66 emerge in favore del Obinutuzumab (P = 0,0849).
La terapia con un inibitore orale della chinasi BKT: l’Ibrutinib
Il progresso terapeutico di questi ultimi anni non si limita ai nuovi anticorpi monoclonali. Lo studio dei processi di proliferazione e maturazione cellulare hanno, infatti, permesso di individuare una via metabolica molto importante per la proliferazione e la sopravvivenza della cellula leucemica della LLC5. Tale via si attiva attraverso i recettori autoreattivi della cellula B (BCRS).I segnali a questi recettori implicano l’attivazione di alcuni enzimi tirosinchinasici, di cui i più importanti sono lo spleen tyrosine kinase (Syk) e la tirosina chinasi di Bruton (BTK), PI3K-delta. L’inibizione di questi enzimi può portare ad una riduzione della proliferazione ed ad un aumento dell'apoptosi. Risposte cliniche particolarmente promettenti sono state già ottenute con inibitori delle chinasi BTK e del PI3K-delta. Diversi studi con l’Ibrutinib, un inibitore orale della chinasi BKT, da solo o in combinazione con le terapie attualmente utilizzate per i pazienti con leucemia linfocitica cronica (CLL), sono stati presentati al 55° Meeting Annuale della American Society of Hematology nel Dicembre 2013.
L’Ibrutinib (Imbruvica), che è commercializzato da California-based Pharmacyclics , è stato recentemente approvato come monoterapia per pazienti con linfoma mantellare, che hanno ricevuto almeno una precedente terapia. Il farmaco orale ha ricevuto dalla FDA la designazione ad una Breakthrough Therapy (Terapia Compassionevole) nel mese di aprile 2013 per i pazienti con LLC ad alto rischio o linfoma a piccoli linfocitica (SLL), che presentano una delezione nel cromosoma 17 (delezione 17p) in quanto ad altissimo rischio. E’ noto che i pazienti con LLC che presentano la delezione 17p hanno generalmente scarsi risultati quando trattati con regimi di chemioterapia e immunoterapia standard. L’Ibrutinib inibisce specificamente la tirosina chinasi di Bruton (BTK), una componente fondamentale sia nella cellula normale che maligna. Il suo compito è modulare il microambiente tumorale e promuovendo la sopravvivenza e la crescita di CLL, dopo la segnalazione ai recettori delle cellule B.
Finora, il farmaco ha dimostrato minore tossicità per i pazienti rispetto ai regimi di trattamento standard. Come riportato dal New England Journal of Medicine, nello studio PCYC-1102 di fase Ib/II, i pazienti (N = 85), con LLC in recidiva refrattaria, che avevano ricevuto 420 mg di Ibrutinib in monoterapia al giorno, presentavano un tasso di risposta globale (ORR) del 71%, con una sopravvivenza libera da progressione stimata (PFS), a 26 mesi del 75%.
L’Ibrutinib è stato testato in monoterapia anche come terapia iniziale con risultati incoraggianti, come riportato recentemente da Lancet Oncology. L’Ibrutinib è stato sperimentato anche in associazione con altri farmaci classicamente attivi nella LLC, quali il Rituximab e la Bendamustina.
L’associazione di Ibrutinib ed il Rituximab
In uno studio sempre presentato all’ASH 2013, si è visto che l’Ibrutinib, quando associato al Rituximab, produce un tasso di risposta del 95% nei pazienti con LLC. La combinazione ha determinato una risposta in 37 dei 39 pazienti affetti da LLC sul processo che potrebbe essere valutata. Trentaquattro pazienti hanno raggiunto una remissione parziale (87%) e tre pazienti hanno avuto una remissione completa (8%) .La combinazione ha comportato un’ intensa attività in pazienti con LLC ad alto rischio ed è stato ben tollerato. L'aggiunta di Rituximab accelera chiaramente le risposte nella LLC, rimane il dubbio se questa risposta si tradurrà in un sostanziale beneficio per i pazienti nel lungo periodo. La combinazione ha anche migliorato la qualità della vita dei pazienti. Ad un follow-up mediano di 14 mesi, 31 dei 40 pazienti sono ancora in trattamento ( di cui 16 su 20 pazienti con delezione 17p o mutazione del TP53) senza progressione della malattia . La sopravvivenza globale stimata a 18 mesi è di 84%. Diversi pazienti hanno, però, avuto complicanze infettive, tra cui sei pazienti con polmonite e tre infezioni respiratorie superiori . Eventi avversi di minore gravità includono ecchimosi , ematoma subdurale, affaticamento, dolore alle ossa ed artralgie.Nuove sperimentazioni
Attualmente, è in corso di sperimentazione uno studio clinico di fase III, randomizzato con 150 pazienti (NCT01973387). E’ importante sottolineare che l’Ibrutinib si dimostra efficace, indipendentemente dalla delezione del 17p. Lo ha anche dimostrato la ricerca del Dr. Mohammed Farooqui, della Ematologia del National Institutes of Health a Bethesda, che in uno studio monocentrico ha incluso pazienti precedentemente trattati che naïve al trattamento dividendoli in due coorti:
- quelli senza delezione 17p ( n = 24 );
- quelli con una delezione 17p rilevabile (n = 29).
A 20 mesi , nessuno dei pazienti senza delezione 17p ha progredito e l'85 % dei pazienti con delezione 17p - positivi rimane in trattamento. L'ottanta per cento dei pazienti senza delezione 17p ha avuto una risposta parziale, come pure il 53 % di quelli con delezione 17p. Un altro 9% dei pazienti senza delezione 17p e il 43 % dei pazienti con una delezione 17p avevano un risposta parziale con linfocitosi (PRL). Risposta linfonodale è stata del 100 % in entrambi i gruppi , con una riduzione della massa tumorale linfonodale del > 70 % e del > 40 % di riduzione del volume della milza , così come una riduzione > 75 % nel tumore infiltrazione nel midollo osseo in entrambi i gruppi di pazienti.
A 14 mesi, la sopravvivenza libera da eventi stimato è del 93 %. A 6 mesi, il 66 % ( 31 pazienti ) ha avuto una risposta parziale e il 28 %(13 pazienti) ha avuto un PRL .
La comparsa di linfocitosi dopo Ibrutinib ha indotto a sperimentare l’aggiunta di un chemioterapico classico, la Bendamustina, alla combinazione Ibrutinib-Rituximab (Rituxan). Questa associazione ha dimostrato un elevato livello di attività con buona tollerabilità nei pazienti con LLC recidivante o refrattaria. Nella presentazione dei risultati finali dello studio di 30 pazienti, quelli con un marcatore molecolare della malattia ad alto rischio e quelli con malattia estesa, erano ugualmente in grado di rispondere.
La percentuale di risposte è stata del 93,4 % (28 /30) di cui cinque risposte complete e tre risposte nodale parziali, senza differenze nelle risposte basate su caratteristiche di rischio come la delezione 17p. Questi risultati suggeriscono che queste risposte sono superiori a quelle osservate negli studi precedenti di fase precedente II con Bendamustina e Rituximab da soli. I pazienti hanno tollerato il regime di tre farmaci relativamente bene : il numero mediano di cicli completati è stato ben sei . Nessun paziente ha interrotto il farmaco a causa di eventi avversi (EA) e nessun decesso è stato riportato nello studio.
Gli eventi avversi più frequenti correlati al trattamento sono stati:
- diarrea (70 %);
- nausea (66,7 %);
- affaticamento (46,7 %);
- neutropenia (40 %);
- infezione del tratto respiratorio superiore (36,7 %).
Gli eventi avversi ≥ grado 3 includono neutropenia (40 %), rash maculopapulare (10 %) e affaticamento (10 %), e così come la cellulite , trombocitopenia e neutropenia febbrile (6,7 % ciascuno). L’altro inibitore della via metabolica utilizzato in terapia è l’Idelalisib, un inibitore altamente selettivo della PI3K delta ,che si ritrova principalmente nei leucociti. La molecola ha un ruolo centrale nella attivazione, proliferazione, migrazione e sopravvivenza dei linfociti B.
Una sua isoforma induce iperattivazione in una varietà di tumori maligni delle cellule B. L’associazione Idelalisib + Rituximab è stata confrontata con l’associazione Rituximab + placebo. Somministrato a pazienti pesantemente pretrattati , con LLC in recidiva, non adatti per chemioterapia citotossica e ad alto rischio. L’Idelalisib più Rituximab ha significativamente migliorato la sopravvivenza libera da progressione, il tasso di risposta obiettiva , e la sopravvivenza globale. La combinazione con Idelalisib ha anche migliorato la sopravvivenza libera da progressione (PFS), l'endpoint primario dello studio, di oltre il 70 %, rispetto al braccio di confronto costituito da Rituximab più placebo. I due regimi hanno avuto un analogo profilo di eventi avversi (AE).
Risultati positivi degli studi clinici iniziali, hanno portato alla realizzazione di uno studio di fase III. Multicentrico, multinazionale, presentato al 55° Meeting Annuale della American Society of Hematology, lo studio è successivamente stato riportato in esterno in una pubblicazione del New England Journal of Hematology. Gli investigatori, Americani ed Europei, hanno randomizzato, in un rapporto 1:1, 220 pazienti con LLC recidiva/refrattaria a ricevere Rituximab più Idelalisib (150 mg due volte al giorno) o placebo. Il trattamento è stato programmato per continuare per 6 mesi. Alla progressione, i pazienti potevano continuare il trattamento in uno studio di estensione in monoterapia. L’analisi dell’ OS ha prodotto un hazard ratio di 0,28 , che rappresenta una riduzione del 72 % del rischio per i pazienti trattati con Idelalisib rispetto al placebo (95 % CI , 0,09-0,86 , P = .018 ). Il tasso di risposta obiettiva, un endpoint secondario costituito dalla riduzione delle organomegalie, era sei volte superiore con Idelalisib rispetto al placebo (81 % vs 13% ; odds ratio = 29.92 , p < .0001).
Linfoadenopatia risultava migliorata in tutti i pazienti nel braccio Idelalisib, ed il 93% dei pazienti ha avuto almeno un miglioramento del 50 %, il criterio di risposta linfonodo. Al contrario, il 4% dei pazienti trattati con placebo ha avuto risposte linfonodali. Più del 90 % dei pazienti in ciascun gruppo ha avuto almeno un evento avverso. Gli eventi avversi più comuni (tutti i gradi) nel gruppo Idelalisib sono stati:
- iperpiressia (29%) ;
- affaticamento (24%);
- nausea (24 %);
- brividi (22%);
- diarrea (19%).
Nel braccio placebo, invece, gli eventi avversi più comuni (tutti i gradi) sono stati:
- le reazioni da infusione (28%);
- affaticamento (27%);
- tosse (25%);
- nausea (22%);
- dispnea (19%).
L'incidenza di grado ≥ 3 eventi avversi è stata del 56,4 % con Idelalisib contro il 47,7% con il placebo. Eventi avversi gravi si sono verificati nel 40% del gruppo idelalisib e 34,6% del gruppo placebo. Il tasso di interruzione associato ad eventi avversi è stato del 8,2% nel braccio Idelalisib e del 10,3% nel gruppo placebo. Inoltre, quattro morti (3,6%) si sono verificati nel gruppo Idelalisib, e 12 (11,2%) nel gruppo placebo.
Come si accede a determinate terapie?
I pazienti con malattia in fase attiva o sintomatica o con stadi avanzati Binet o Rai richiedono una terapia. Per i pazienti in età <70 anni ed in buone condizioni, chemio e immuno terapia con Fludarabina, Ciclofosfamide e Rituximab, rappresenta la terapia standard attuale. Per i pazienti anziani o con comorbidità, il trattamento con un anticorpo anti-CD20 più una chemioterapia più mite (Chlorambucil) è, al momento, considerata come trattamento standard.
Alla ricaduta, il trattamento iniziale può essere ripetuto, se l'intervallo libero da trattamento superiore a due anni. Se la malattia ricade prima, devono essere utilizzate terapie alternative con il Rituximab, o Ofatumumab ed - eccezionalmente - l’Alemtuzumab, associati a lenalidomide, o bendamustine. I pazienti con il 17p o TP53, invece, dovrebbero essere considerati per un trapianto allogenico di cellule staminali emopoietiche. La situazione dovrebbe radicalmente cambiare con i nuovi farmaci non ancora in commercio in Europa. I nuovi agenti (ad esempio, Ibrutinib, Obinutuzumab ed Idelalisib), detengono il potenziale per cambiare il livello di trattamento CLL nei prossimi 6-12 mesi. Pertanto, i pazienti affetti da LLC, dovrebbero essere inclusi negli studi clinici in corso anche in Italia, appena possibile.
Bibliografia
- Tam CS, O'Brien S, Wierda W, Kantarjian H, Wen S, Do KA, Thomas DA, Cortes J, Lerner S, Keating MJ. Long-term results of the fludarabine, cyclophosphamide, and rituximab regimen as initial therapy of chronic lymphocytic leukemia. Blood. 2008 Aug 15;112(4):975-80. doi: 10.1182/blood-2008-02-140582. Epub 2008 Apr 14.
- Zhou Y, Tang G, Medeiros LJ, McDonnell TJ, Keating MJ, Wierda WG, Wang SA. Therapy-related myeloid neoplasms following fludarabine, cyclophosphamide, and rituximab (FCR) treatment in patients with chronic lymphocytic leukemia/smalllymphocytic lymphoma. Mod Pathol. 2012 Feb;25(2):237-45. doi: 10.1038/modpathol.2011.158.
- Laurenti L, Vannata B, Innocenti I, Autore F, Santini F, Piccirillo N, Za T,Bellesi S, Marietti S, Sica S, Efremov DG, Leone G. Chlorambucil plus Rituximabas Front-Line Therapy in Elderly/Unfit Patients Affected by B-Cell Chronic Lymphocytic Leukemia: Results of a Single-Centre Experience. Mediterr J HematolInfect Dis. 2013 May 2;5(1):e2013031. doi: 10.4084/MJHID.2013.031. Print 2013.
- Labella, Rossella. "Valutazione di nuovi marcatori molecolari di prognosi e risposta terapeutica nella leucemia linfatica cronica-B." (2012).
- Barth MJ, Czuczman MS. Ofatumumab: a novel, fully human anti-CD20 monoclonalantibody for the treatment of chronic lymphocytic leukemia. Future Oncol. 2013Dec;9(12):1829-39. doi: 10.2217/fon.13.219.
- Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, Wendtner CM, Chagorova T,de la Serna J, Dilhuydy MS, Illmer T, Opat S, Owen CJ, Samoylova O, Kreuzer KA,Stilgenbauer S, Döhner H, Langerak AW, Ritgen M, Kneba M, Asikanius E, Humphrey K, Wenger M, Hallek M. Obinutuzumab plus Chlorambucil in Patients with CLL and Coexisting Conditions. N Engl J Med. 2014 Jan 8. [Epub ahead of print] Pu.
- Efremov DG, Wiestner A, Laurenti L. Novel Agents and Emerging Strategies forTargeting the B-Cell Receptor Pathway in CLL. Mediterr J Hematol Infect Dis. 2012;4(1):e2012067. doi: 10.4084/MJHID.2012.067. Epub 2012 Oct 9.
- Byrd JC, Furman RR, Coutre SE, Flinn IW, Burger JA, Blum KA, Grant B, Sharman JP, Coleman M, Wierda WG, Jones JA, Zhao W, Heerema NA, Johnson AJ, Sukbuntherng J, Chang BY, Clow F, Hedrick E, Buggy JJ, James DF, O'Brien S. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med. 2013 Jul 4;369(1):32-42. doi: 10.1056/NEJMoa1215637. Epub 2013 Jun 19.
- Coutre SE, Sharman JP, Burger JA, Blum KA, Grant B,Richards DA, Coleman M, Wierda WG, Jones JA, Zhao W, Heerema NA, Johnson AJ,Izumi R, Hamdy A, Chang BY, Graef T, Clow F, Buggy JJ, James DF, Byrd JC.Ibrutinib as initial therapy for elderly patients with chronic lymphocyticleukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol. 2014 Jan;15(1):48-58. doi: 10.1016/S1470-2045(13)70513-8.Epub 2013 Dec 10.
- un Medico, Sei, and Cerca Chiudi. "Recenti Progressi nella Diagnosi e Terapia della Leucemia Linfatica Cronica.
- Farooqui M, Aue G, Valdez J, et al. Single agent ibrutinib (PCI-32765) achieves equally good and durable responses in chronic lymphocytic leukemia (CLL) patients with and without deletion 17p. Presented at: the ASH 55th Annual Meeting; December 7-10, 2013; New Orleans, LA. Abstract 673.
- Burger JA, Keating MJ, Wierda WG, et al. ibrutinib in combination with rituximab (iR) is well tolerated and induces a high rate of durable remissions in patients with high-risk chronic lymphocytic leukemia (CLL): new, updated results of a phase II trial in 40 patients. Presented at: the ASH 55th Annual Meeting; December 7-10, 2013; New Orleans, LA. Abstract 675.
- Confalonieri, Valeria. "LEUCEMIA LINFATICA CRONICA."
- Brown,Barr PM, et al. Ibrutinib in combination with bendamustine and rituximab is active and tolerable in patients with relapsed/refractory CLL/SLL: final results of a phase 1b study. Presented at: the ASH 55th Annual Meeting; December 7-10, 2013; New Orleans, LA. Abstract 525.
- Furman RR, Sharman JP, Coutre SE, Cheson BD, Pagel JM, Hillmen P, Barrientos JC, Zelenetz AD, Kipps TJ, Flinn I, Ghia P, Eradat H, Ervin T, Lamanna N, Coiffier B, Pettitt AR, Ma S, Stilgenbauer S, Cramer P, Aiello M, Johnson DM, Miller LL, Li D, Jahn TM, Dansey RD, Hallek M, O'Brien SM. Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med. 2014 Jan 22. [Epub ahead of print].


