Natale Pennelli, Gigliola Ludovichetti, Gianmaria Pennelli
Premessa
La conoscenza delle basi anatomo-patologiche della Medicina è sicura guida per un adeguato orientamento diagnostico, prognostico e terapeutico. Il malato denuncia sintomi che vanno valutati anche in chiave anatomo-isto-citopatologica. La preparazione professionale ed il buon senso del Medico, spesso senza la possibilità di una collaborazione da parte del Paziente, dovranno dapprima centrare e poi costruire la nosologia dei singoli casi.
Servizio di Anatomia Patologica: cos'è?
Il Servizio di Anatomia Patologica è uno dei Servizi a disposizione dei clinici nell'interesse dei malati. Tale Servizio si articola in diverse branche:
- attività di settorato (per l'esecuzione di necroscopie);
- attività istopatologica (per controllo diagnostico di pezzi operatori, per la stadiazione patologica post-operatoria e per la definizione istologica di campioni bioptici);
- attività di citologia (per lettura di materiale citologico ai fini della prevenzione o per la diagnosi ambulatoriale agoaspirativa o di altri prelievi ambulatoriali e/o intraoperatori).
Strettamente correlate con queste attività si stanno sempre più sviluppando metodiche speciali ai fini di una interpretazione anche funzionale del reperto morfologico (patologia clinica integrata).
Quali sono le metodiche speciali per l'interpretazione del reperto morfologico?
La più importante nuova metodica è la immunoistochimica, di sempre più frequente utilizzo complementare nella diagnostica isto e citologica routinaria. Anche la biologia molecolare e la citometria a flusso, la morfometria e la microscopia elettronica, se adeguatamente utilizzate, hanno di recente dimostrato un ruolo importante e talora insostituibile nella migliore definizione clinico-patologica delle neuropatie, miopatie, nefropatie, tumori endocrini, linfomi, ecc. Altre moderne procedure a disposizione del patologo sono la telepatologia e il sistema Internet che si stanno rivelando di grande utilità per la consultazione diagnostica, l'automatizzazione dello screening citologico e l'aggiornamento a distanza tra patologi. La telepatologia dinamica, con la trasmissione diretta e continua dell'immagine in tempo reale, ha trovato infine utile applicazione per gli esami intraoperatori effettuati in ospedali isolati,sprovvisti di un patologo (14).
Quando e come utilizzare il Servizio di Anatomia Patologica?
In effetti succede troppo spesso che un campione biologico giunga all' anatomopatologo gravemente deteriorato. Non solo, quante volte il modulo di richiesta d'esame che accompagna il campione (che è l'unico mezzo che consente all' anatomopatologo di individuare i singoli Pazienti e di ricollegarne il presente campione ad eventuali altri che l'hanno preceduto) è impreciso, vago, disorientante? Ogni laureando Medico deve sapere come rivolgersi al Servizio di Anatomia Patologica per utilizzarne le possibilità diagnostiche e deve sapere come compilare correttamente una richiesta d' esame istologico.
Cos’è la richiesta di esame istologico e/o citologico?
La richiesta d' esame istologico e/o citologico rappresenta un documento ufficiale, al quale si fa riferimento in caso di contestazioni e serve all' anatomopatologo per conoscere:
- le necessarie informazioni cliniche relative alla sintomatologia di una particolare condizione patologica e utilizzarle a fini diagnostici;
- la terapia eseguita;
- i precedenti anamnestici.
Si ricordi che è deontologicamente e legalmente scorretto che i pezzi operatori o i campioni citologici prelevati ad un Paziente siano eliminati senza previa indagine anatomopatologica.
Un'adeguata raccolta e conservazione del materiale biologico da sottoporre ad esame microscopico è indispensabile per la costruzione del documento e per l'esatta interpretazione dei dati. Si predispongano e si usino possibilmente dei contenitori di plastica con tappo a tenuta: vi vanno sempre indicate le generalità del Paziente con le essenziali precisazioni, che vanno poi dettagliatamente riportate sul modulo di richiesta. Per eventuali esigenze speciali si consulti per tempo l'anatomopatologo (8).
Che ruolo ha il personale sanitario paramedico?
Il personale sanitario paramedico (infermieri, tecnici di laboratorio, citotecnici, ecc.) deve collaborare con il Medico provvedendo ad eseguire le manipolazioni tecniche più adeguate per una ottimale conservazione dei campioni e la corretta compilazione della Richiesta d'esame. La recente istituzione del Diploma Universitario (cosiddetta "laurea breve") per infermieri, tecnici sanitari di laboratorio biomedico, ecc. ha lo scopo di formare un ruolo intermedio di professionisti che siano culturalmente in grado di operare con autonomia e responsabilità, per quelle mansioni di loro competenza, nei vari settori in cui è articolata l'assistenza sanitaria (9).
Pezzi operatori, biopsie e citologie
1. Tutti i campioni biologici da fare esaminare vanno posti (se non diversamente concordato) in adeguata quantità di liquido fissativo. Adeguata quantità significa almeno lO parti di fissativo per ogni parte (in volume) del pezzo da fissare. Il liquido fissativo deve essere preparato nel contenitore dei pezzi prima che questi vi vengano depositati, altrimenti il pezzo si attacca sul fondo del recipiente ed il fissativo non lo avvolge uniformemente. Si usi comunemente la Formalina al 10% che si prepara diluendo l parte di formolo (confezioni commerciali di aldeide formica al 40% in voI.) con 9 parti di acqua. I pezzi in formalina possono essere conservati indefinitamente.
2. Per i piccoli frammenti bioptici si raccomanda l'immediata fissazione in liquido di DUBOSQ-BRAZIL (formolo cc 240, alcool etilico 80°cc 600, acido acetico glaciale cc 60, acido picrico soluzione acquosa satura cc 8) od in liquido di BOUIN (soluzione acquosa satura di acido picrico parti 15, formolo p. 5, acido acetico glaciale p. l). Tali due ultimi fissatori possono essere tempestivamente richiesti al nostro Istituto o conservati già pronti presso i Reparti. Un piccolo campione è bene non resti in tali fissativi oltre 24 ore. Sui pezzi così preparati l'anatomopatologo e i tecnici procederanno poi allo sgrossamento e alla rifinitura dei campioni da includere fino all'allestimento dei vetrini istologici per la lettura. Gli usuali tempi tecnici dal ricevimento del pezzo da esaminare alla refertazione della diagnosi istopatologica richiedono due o tre giornate lavorative, qualora non sia necessario ricorrere all'utilizzo di metodiche speciali.
3. Particolare attenzione richiede il prelievo e l'invio di linfonodi. Infatti, la maggior parte dei problemi insoluti nei linfomi è dovuta ad alterazioni del materiale inviato per artefatti di prelievo o di fissazione. L'istologia di routine rimane l'indagine più importante nella diagnostica dei linfomi anche se spesso è richiesto l'utilizzo di tecniche speciali (immunoistochimica su materiale fissato o congelato, tecniche di biologia molecolare, microscopia elettronica ecc.) per una migliore definizione diagnostica. Per una più valida applicazione dell'immunoistochimica è utile la fissazione in B5 (miscela di sublimato e formaldeide). Bisogna infatti tenere a mente che anche per l'immunoistochimica possono verificarsi reperti "falsi positivi" (colorazione di fondo, attività di enzimi endogeni, errori di esecuzione nella tecnica, ecc.) e "falsi negativi" soprattutto per inadeguata fissazione (4). Reperti inattesi si riferiscono alla reazione dell'anticorpo con epitopi di una molecola e non con la molecola intera o la cellula. È utile la valutazione citologica su "imprints"di tessuto fresco. Per lo studio citogenetico e microbiologico si richiedono sospensioni cellulari in condizioni di massima sterilità.
4. Nell'ambito della CITOLOGIA è bene distinguere:
- "citologia di screening": proviene da soggetti clinicamente asintomatici ed ha lo scopo di assicurare la massima affidabilità al referto di "negatività" per precursori cellulari maligni, per aspetti di patologie infiammatorie o per quadri disendocrini;
- "citologia diagnostica": riguarda soggetti sintomatici, cioè portatori di una qualche lesione, per i quali l'accertamento di natura presuppone non solo una buona esperienza citologica ma anche una conoscenza di base dell' istopatologia, dell'anatomia patologica in generale e in tutte le sue espressioni, comprese quelle di tipo specialistico.
La diagnosi citologica si è enormemente sviluppata in questi ultimi decenni e rappresenta un valido ausilio della medicina moderna per la sua facile applicazione in tutte le sedi del corpo (5). Papanicolaou, nel 1920 pubblicò il metodo di citodiagnostica vaginale per la valutazione ormonale e per la diagnosi precoce del cancro cervicale. La tecnologia moderna permette di eseguire prelievi con ago sottile non solo in masse superficiali ma anche su piccoli nodi profondi intraparenchimali sotto guida ecografica o con l'ausilio della TAC o della RMN. In mani esperti la citologia è diventata una pratica clinica molto importante che l' anatomopatologo utilizza a scopo diagnostico a conferma del sospetto clinico e/o radiologico di masse palpabili o non palpabili presenti nelle sedi più diverse, superficiali o profonde.
Un costante controllo di qualità a tutti i livelli del laboratorio di istologia e citologia (segreteria, archiviazione dati, esecuzione tecnica, screening citologico, ecc.) deve assicurare un alto standard di accuratezza diagnostica ("benchmark"), quanto più vicino possibile a quello indicato nei più qualificati laboratori internazionali.
Versamenti in cavità sierose
1. Vanno eparinizzati a circa l'uno per mille (od altrimenti trattati, ad es.: adde mI 1 di sodio citrato al 3,8% per mI IO del versamento) per evitarne la coagulazione subito dopo il prelievo. Se coagulano risultano poi inutilizzabili. Il campione va inviato al più presto al laboratorio di anatomia patologica. Se tale campione non può essere subito recapitato, bisogna conservarlo in frigorifero ("non sotto zero"). A questo punto:
- se un versamento è limpido ed il Medico richiede la ricerca di cellule neoplastiche, è necessario inviare una maggiore quantità di liquido (100-200- cc);
- se il versamento è torbido, ciò indica sicuramente che la sua cellularità è più elevata e quindi può bastarne molto meno.
2. Le cavità sierose sono delimitate da mesotelio che a seguito di stimoli di varia natura dà luogo alla formazione di un fluido in cui sfaldano le cellule di rivestimento della sierosa ( mesoteli normali, iperplastici, atipici, ecc.) non di rado commisti a elementi di tipo infiammatorio (macrofagi, fibroblasti, ecc.) o a cellule neoplastiche estrinseche (adenocarcinomi, linfomi, ecc.). La valutazione citologica dei versamenti nelle cavità sierose può presentare notevoli difficoltà nella diagnosi differenziale con i processi iperplastico-reattivi, il mesotelioma, i sarcomi e le metastasi di adenocarcinoma (l). Il mesotelio infatti, per la sua derivazione mesodermica, è un'unità dotata di potenzialità bifasica che può assumere di volta in volta caratteristiche morfologiche simil-epiteliali o simil- fibroblastiche. Il mesotelioma è una neoplasia che per le implicazioni terapeutiche, prognostiche e medico-legali, richiede particolare attenzione da parte del patologo. Prima di affrontare lo studio citologico è bene valutare sempre la storia clinica (esposizione all' asbesto), il reperto radiologico e la eventuale presenza di un versamento ematico non altrimenti giustificato.
Cos’è l’iperplasia delle cellule mesoteliali?
L'iperplasia delle cellule mesoteliali è un processo reattivo a varie condizioni patologiche quali:
- infezioni (polmoniti, ascessi,ecc.);
- infarti (embolismo, infarto del polmone, infarto intestinale, ecc.);
- cirrosi ed epatiti;
- collagenopatie sistemiche;
- trattamenti radianti e/o chemioterapia;
- pleuriti virali o tubercolari;
- tumori polmonari subpleurici benigni (amartomi ) o maligni;
- pneumoconiosi croniche progressive (asbestosi, ecc.);
Per quanto riguarda la morfologia è bene tener presente che tutte le cellule che permangono a lungo in un fluido tendono ad assumere forma globosa, e vanno incontro a fenomeni regressivi citoplasmatici di vario grado. Queste alterazioni si possono riscontrare in modo variabile sia in cellule normali che in elementi neoplastici. La ricca cellularità di uno striscio e un abnorme pattern di aggregazione dei mesoteli in morule o papille hanno significato di atipia, ma possono talora essere indotti dal procedimento tecnico di centrifugazione del fluido durante le manovre di arricchimento. Nei mesoteli i nuclei molto voluminosi, duplici, ipercromici, nucleolati o anche in mitosi non sono necessariamente indicativi di malignità. Infine la presenza di papille con stroma collageno o l'evidenza di corpi psammomatosi o di cellule signet-ring non sono reperti diagnostici definitivi (Fig. 1-8).
Come si diagnostica?
I principali criteri citologici per la diagnosi di mesotelioma maligno sono:
- cospicuo aumento della cellularità, monomorfismo cellulare;
- maggiori dimensioni dei mesoteli maligni rispetto ai mesoteli normali e/o reattivi;
- forme allungate e/o bizzarre dei citoplasmi mesoteliali;
- pleomorfismo nucleare con aggregati cromatinici;
- nucleoli voluminosi;
- mitosi frequenti
A differenza dall'adenocarcinoma, le cellule del mesotelioma lasciano quasi sempre riconoscere una zona di citoplasma marginale più pallida, priva di organuli e ricoperta da lunghi e irregolari microvilli (Fig. 9). In casi in cui i dati clinici siano contrastanti e non si abbia la certezza di una diagnosi differenziale si possono applicare tecniche speciali quali la immunoistochimica e la microscopia elettronica (Tab. l).
Urine
1. Ne vanno raccolti possibilmente non meno di 50 cc in recipiente contenente circa cc 20 di formalina al 10%. In pratica, si faccia minare il Paziente in un vaso dove sarà messa già prima un po' di formalina al 10%. Si tenga presente che per l'indagine citodiagnostica non serve raccogliere ed inviare "le urine delle 24 ore"! Se siete vicini al laboratorio di anatomia patologica, potete inviare anche urine fresche, senza fissativo.
2. Versamenti ed urine, come pure liquidi di lavaggio, potranno così essere congruamente trattati nel laboratorio anatomoistocitopatologico, ove si procederà alla loro centrifugazione , al fissaggio del sedimento, alla sua inclusione, affettatura e colorazione nel modo del tutto analogo ad un campioncino solido. Sarà solo l’ anatomopatologo a decidere se, di fronte a troppo esiguo sedimento corpuscolato, sarà il caso di allestire degli strisci piuttosto che procedere all'inclusione.
3. La citologia urinaria può presentare difficoltà interpretative specie in assenza di adeguate informazioni cliniche. L'urina emessa spontaneamente, infatti, è meno ricca di cellule uroteliali di quella ottenuta tramite cateterismo o lavaggio.
Normalmente, per fenomeni degenerativi, si rinvengono cellule di dimensioni variabili e forma ovalare o allungata, con citoplasma abbondante, spesso vacuolizzato. Un esempio è costituito dalle cellule ad ombrello multinucleate di derivazione vescicale e/o ureterale;
Nei processi infiammatori del basso tratto urinario compaiono:
- emazie;
- aggregati di granulociti; ù
- macrofagi mono o plurinucleati (Fig. l0);
- agenti infettivi batterici (Escherichia coli, Pseudomonas aeruginosa) o micotici (Candida Albicans);
Caratteristiche sono alcune alterazione citopatiche da infezioni virali come:
- citomegalovirus (inclusioni citoplasmatiche e/o nucleari con alone);
- herpes simplex (epiteli multinucleati e nuclei a vetro smerigliato);
- polioma (inclusioni nucleari singole e omogenee, nucleo vuoto con grossi cromocentri di aspetto pseudomaligno);
- papilloma virus ( coilocitosi di epiteli uretrali)
Fra le parassitosi ricordiamo:
- trichomonas vaginalis;
- schistosoma haematobium: frequente in soggetti provenienti dall' Africa e in particolare dall'Egitto ed è non di rado associata con il carcinoma della vescica.
Tumori alla vescica: come comportarsi?
Per quanto riguarda i tumori vescicali possiamo distinguere tre gruppi principali:
- tumori uroteliali (papillari e non papillari,Fig. 11-12),
- tumori squamosi,
- tumori ghiandolari simil-enterici.
Le atipie delle cellule uroteliali possono essere di grado lieve (nucleo rotondo con lieve ipercromasia) o di grado marcato (cellule con citoplasma irregolare e nucleo fortemente ipercromico). Particolarmente importante è la diagnosi citologica urinaria per il carcinoma uroteliale non papillare in situ e nel follow-up di pazienti già trattati per neoplasie uroteliali papillari. Nel carcinoma invasivo le atipie cellulari sono in genere associate alla presenza di segni infiammatori e/o di necrosi cellulare. Adeguate notizie cliniche permetteranno di evitare grossolani errori interpretativi nella valutazione di urine ottenute da vescica ileale (Fig. 13) o da soggetti radio e/o chemiotrattati.
Recentemente si utilizzano sistemi di screening automatizzati interattivi (PAPNET) di campioni urinari, analogamente a quanto effettuato in citologia ginecologica cervico-vaginale per i buoni risultati ottenuti nella diagnosi differenziale con le pseudo atipie reattive e/o infiammatorie.
Escreato e "Bal"
Escreato
1. È utile quello emesso al risveglio mattutino.
2. Prima di raccoglierlo:
- far sciacquare abbondantemente la bocca con acqua fresca, possibilmente gargarizzando;
- non far lavare i denti con dentifrici o colluttori;
- non somministrare cibi, né bevande, salvo, se gradita, una tazza di tè;
- far giacere il paziente per un po' (qualche ora se è possibile) sul lato opposto a quello in cui si sospetta la neoplasia polmonare per facilitare il deflusso delle secrezioni in trachea;
- invitare quindi il Paziente ad espettorare direttamente nel recipiente contenente il liquido di Dubosq-Brazil.
È consigliabile far esaminare l'escreato per almeno 3 mattine consecutive. Si tenga presente che, in casi di insufficiente secrezione bronchiale spontanea, è possibile indurre adeguata espettorazione previa inalazione aerosolica di una soluzione di glicole propilenico al 15-20% in soluzione salina al 15%.
3. La citologia dell' espettorato viene utilizzata per confermare il sospetto di neoplasia o per accertare l'istotipo del tumore per un più efficace programma terapeutico. Non è proponibile uno screening di popolazione se non per soggetti particolarmente a rischio (lavoratori in miniere di uranio o operai esposti a fumi tossici per presenza di nichel, cromo cobalto, ecc).
4. Le cellule nell'espettorato si conservano anche per 10-12 ore senza fissazione e derivano dal cavo orale (elementi piatti), dalla mucosa tracheo-bronchiale (elementi cilindrici, cellule caliciformi mucipare) , La presenza di macrofagi alveolari è inoltre indice di adeguatezza del campione. Fra le componenti non cellulari dell' espettorato ricordiamo le spirali di Curschmann (muco addensato in spirali basofile Pas-positive), i corpi dell'asbesto (strutture fibrose incrostate di calcio), i cristalli ottagonali di Charcot-Leyden di derivazione dagli eosinofili, microbi vari e sostanze di contaminazione del cavo orale (vegetali, cellulosa, ecc.).
Come agire in caso di Carcinoma Epidermoide Broncogeno?
Il carcinoma epidermoide broncogeno è caratterizzato dalla presenza di elementi a citoplasma intensamente orangiofilo o acidofilo, di forma allungata, a girino o bizzarra, con aggregazioni a cipolla. Le cellule ombra (ghost celI) sono elementi neoplastici di un carcinoma in necrosi che clinicamente simula un focolaio ascessuale (cancro-ascesso). Il nucleo delle cellule neoplastiche è ipercromico o picnotico e non lascia riconoscere una struttura della cromatina (Fig. 14). Nelle forme meno differenziate le cellule sono più voluminose, a citoplasma basofilo e nucleo vescicoloso, talora macro nucleolato, di forma irregolare a grossi granuli cromatinici alternati ad aree chiare. L'adenocarcinoma, per la sua più frequente localizzazione polmonare periferica (scar-cancer), non viene facilmente diagnosticato nell' espettorato e richiede l'utilizzo della agobiopsia percutanea TAC-guidata (Fig. 15). Più facili e caratteristici sono :
- il reperto del carcinoma bronchiolo-alveolare per l'aspetto tridimensionale degli aggregati cellulari, pattern papillare e la presenza nel citoplasma di vacuoli o granuli PAS positivi;
- il reperto del carcinoma a piccole cellule di derivazione dalle cellule di Kulchitsky (microcitoma). Si tratta di elementi piccoli, riuniti in aggregati poco compatti o disposti in fila indiana con discreta anisocariosi, rapporto N/C invertito, cromatina a grosse zolle e micro nucleoli.
BAL
1. Una particolare metodica diagnostica citologica è quella che '"si effettua sul lavaggio bronchiolo-alveolare (BAL) non tanto ai fini oncologici quanto per valutare alcune condizioni infiammatorie o reattive del polmone correlate ad infezioni, pneumoconiosi, a processi disimmunoreattive e ad alterazioni a farmaci (6).
Come si esegue un BAL?
Il BAL viene eseguito con un broncoscopio flessibile in anestesia locale per l'introduzione nel bronco lobare di 100-300 mI di soluzione fisiologica che viene poi aspirata e inviata in Laboratorio. Quì, dopo filtrazione e centrifugazione, viene eseguita la valutazione citologica dello striscio contando il numero degli elementi presenti e le percentuali delle varie cellule (macrofagi, linfociti, neutrofili, eosinofili, plasmacellule, mastcellule ecc).
Quali informazioni ottengo dal BAL?
Dallo studio morfologico del BAL e da una successiva valutazione immunofenotipica delle cellule è possibile ottenere informazioni utili che, correlate al quadro clinico e radiologico, permettono la diagnosi di varie condizioni patologiche:
- la prevalenza di macrofagi è caratteristica dei fumatori;
- numerosi linfociti sono espressione di una alveolite allergica, da sarcoidosi, da tbc, reattiva a farmaci, da BOOP, ecc.;
- un eccessivo numero di neutrofili depone per un processo di fibrosi polmonare idiopatica, di granulomatosi di Wegener, di ARDS, di infezione, ecc.;
- numerosi eosinofili sono espressione di una broncopolmonite aspergillare, di una polmonite eosinofila o di un processo allergico;
Importante è l'utilizzo immunoistochimico di anticorpi monoclonali per evidenziare le sottopopolazioni linfocitarie presenti nel BAL. La sarcoidosi è associata ad una predominanza di cellule CD4 positive; la istiocitosi X è caratterizzata da cellule CDl positive (Langherans cells) in percentuale alta (circa il 3% del totale);la tbc ha un normale rapporto fra CD4/CD8; la silicosi, la BOOP, l'alveolite da farmaci o da virus (HIV) hanno un ridotto rapporto CD4/CD8.
Agoaspirati e strisci vari
I. Sempre più spesso il medico ricorre all'allestimento di strisci quando pensa che un materiale fluido e di ben scarsa quantità possa fornire preziose informazioni.
Se ne possono ottenere validi campioni da:
- secreti o liquidi vari, ad es: ghiandole salivari, mammari, articolari, vaginali, ascessuali, ecc.;
- campionamenti mediante aspirazione con ago sottile, o per spazzolamento (brushing) essendo ormai infatti ben conosciuta la possibilità di formulare diagnosi citologiche molto accurate con tale metodica
2. Ai Servizi di Anatomia Patologica vengono ormai riconosciuti ambulatori dove il patologo effettua direttamente l'agoaspirazione di masse palpabili. Infatti la conoscenza della clinica (anamnesi, reperto macroscopico, sintomatologia, ecc.) e l'accuratezza del prelievo da parte di chi sarà poi il responsabile della lettura dei preparati citologici migliora notevolmente il risultato diagnostico.
La citologia agoaspirativa delle ghiandole salivari ad esempio permette di diagnosticare con buona predittività i tumori più frequenti quali l'adenoma pleomorfo e il cistoadenolinfoma o tumore di Warthin tra i benigni e il carcinoma adenoido-cistico o il carcinoma mucoepidermoide tra i maligni. Allo stesso modo è possibile diagnosticare le metastasi intra-parotidee o il linfoma parotideo primitivo.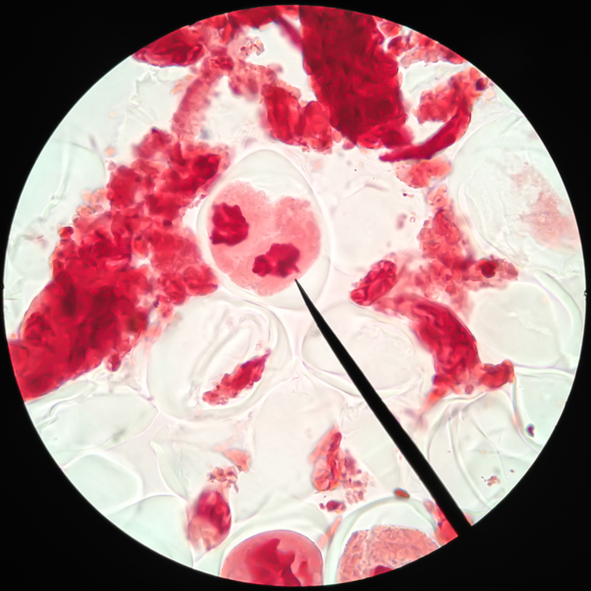
Lesioni mammarie: un caso di citologia agoaspirativa
Nella diagnostica delle lesioni mammarie ci si avvale di tre tipi di -prelievo citologico a seconda che ci troviamo di fronte a:
- secrezioni dal capezzolo;
- lesioni cutanee;
- noduli intraghiandolari.
Nelle secrezioni dal capezzolo è bene innanzitutto tenere a mente il differente significato che assume la secrezione ematica nella mammella maschile rispetto a quella femminile:
- nel maschio, una secrezione ematica dal capezzolo è molto frequentemente indice di una neoplasia maligna sottostante;
- nella donna, la stessa secrezione indica più frequentemente un papilloma dei dotti galattofori piuttosto che un carcinoma.
Ricordiamo che nel caso di secrezioni ematiche è preferibile eseguire almeno quattro vetrini.
Un sempre crescente consenso tra i medici ha trovato la citologia agoaspirativa della mammella per la possibilità che essa offre di fornire diagnosi accurate, veloci ed a costi molto bassi.
Come avviene la citologia agoaspirativa della mammella?
L'esame citologico viene praticato ambulatorialmente anche nelle lesioni non palpabili per le quali l'anatomopatologo ed il radiologo eseguono in collaborazione l'indagine avvalendosi della guida ecografica o stereotassica per il raggiungimento del nodo. La concordanza dell'esame clinico, radiologico (mammografico) e citologico sono in genere sufficientemente diagnostici.
Occorre ribadire che la citologia agoaspirativa costituisce un vero e proprio atto diagnostico poiché viene eseguita su alterazioni patologiche ben definite e non dovrebbe prevedere pertanto la dizione generica di "negatività" (Fig. 16-18). Vi sono infatti lesioni flogistiche (mastiti, steatonecrosi), displastiche (mastopatia fibrocistica, adenosi sclerosante, ecc), neoplastiche benigne (papillomi, fibroadenomi, tumore filloide ecc.) e maligne (carcinoma dottale, lobulare , tumore filloide maligno, sarcomi, ecc.).
Ci sono margini di errore diagnostico?
Gli aspetti citologici delle lesioni mammarie sono stati codificati: nota è ad esempio la "tripletta" diagnostica del fibroadenoma costituita da frammenti di stroma, lembi di epiteti duttali a margini arrotondati e nuclei nudi bipolari sul fondo (Fig. 16).
Tuttavia la grande diffusione della metodica ha evidenziato non poche problematiche di fronte a reperti morfologicamente benigni ma clinicamente maligni e viceversa.
Ad esempio:
- le piccole cellule isolate del carcinoma lobulare possono essere sottovalutate o non riconosciute quando associate ad una lesione benigna prevalente;
- gli aggregati regolari e ben differenziati del carcinoma tubulare confusi con un processo benigno iperplastico;
- atipie cellulari del fibroadenoma possono far correre il rischio di un falso positivo, specie in donne anziane o in gravidanza;
- una precedente radioterapia può indurre atipie citologiche sopravvalutate in pazienti considerati a rischio;
- alterazioni iperplastiche complesse con quadri mammografici sospetti possono indurre ad errate conclusioni di malignità;
- cellule apocrine metaplastiche e degenerate possono simulare elementi atipici;
- necrosi e infiammazione sono condizioni comuni a tumori e a comedomastiti e steatonecrosi a cui si associano atipie epiteliali reattive.
Cosa fare se il paziente è asintomatico?
È previsto uno screening mammario in pazienti "asintomatici" mediante mammografia. In questi casi è possibile evidenziare lesioni (microcalcificazioni irregolari, deformazioni strutturali, ecc.) anche molto piccole (1-3 mm) e decidere per un' eventuale citologia con guida stereotassica seguita dall' asportazione della zona sospetta per il controllo istologico.
Se invece è sintomatico?
In donne invece "sintomatiche" per mastopatia fibrocistica o noduli vari, il reperto mammografico è molto meno sensibile (2). In queste condizioni l'interpretazione mammografica è spesso controversa e pone dubbi nella diagnosi differenziale fra un fibroadenoma e un carcinoma midollare, o fra un carcinoma infiltrante a cellule disperse e proliferazioni dell’epitelio benigne con sclerosi stromale. L’atto del prelievo diventa qui un momento importante e può facilitare il giudizio finale.
In che modo?
È bene che il medico tenga in considerazione la sensazione che si avverte nel momento della penetrazione dell' ago nel nodulo da indagare, specie se il prelievo viene eseguito solo con l'ago, senza aspirazione:
- nodulo soffice è compatibile con fibroadenoma o con un carcinoma midollare e/o mucoide;
- la resistenza gommosa orienta per la mastopatia fibrocistica ma non esclude il carcinoma o il fibroadenoma;
- la percezione dell'ago che stride nella lesione può deporre per un carcinoma con sclerosi e calcificazione ma anche per un vecchio fibroadenoma o per una adenosi sclerosante benigna.
Questi dati vanno pertanto opportunamente comparati con il reperto citologico. Nei casi in cui vi sia scarsa cellularità o il prelievo risulti eccessivamente ematico, è utile ricorrere alla "core biopsy", cioé ad un prelievo mirato eseguito con ago tranciante per lo studio istologico dopo inclusione.
La pratica in sé è rischiosa?
Le complicanze dell'agospirato mammario sono rare tranne forse per la formazione di un ematoma che può essere prevenuto con adeguata compressione dopo il prelievo. Ormai esclusa l'eventualità di diffusione mediante il tramite dell'ago, l'unica vera complicanza rimane il pneumotorace che può verificarsi quando si debbano pungere noduli in vicinanza delle coste e l'ago attraversi il muscolo intercostale e la pleura.
Perchè dovrei sottopormi a questa pratica?
Il ruolo più importante nella diagnosi citologica della mammella è la decisione fra lesione benigna e maligna. Tale differenza ha conseguenze cliniche drammatiche ed è bene che il chirurgo sia consapevole che vi sono condizioni in cui questa decisione è decisamente difficile. Vi sono minime differenze fra alcune lesioni iperplastiche fibroadenomatose benigne e il carcinoma dottale ben differenziato o fra il cosiddetto fibroadenoma atipico e il carcinoma mammario. Alla abilità ed esperienza del patologo deve corrispondere sempre una costante prudenza da parte del chirurgo nell'attuare mastectomie di casi con aspetti clinici, mammografici e citologici contrastanti. Si ricordi che dopo la valutazione citologica è sempre possibile ricorrere alla diagnosi intraoperatoria con l'uso del criostato o, in casi meno sospetti, alla tumorectomia e/o alla biopsia escissionale per un successivo accertamento istologico.
Linee guida per l’Agoaspirazione Eco
Anche per l'agoaspirazione Eco o Tac-guidata è molto utile la presenza del patologo al prelievo citologico per la valutazione immediata del campione anche solo in termini di adeguatezza del campionamento. È infatti una pratica ormai diffusa quella di effettuare colorazioni "rapide" subito dopo il prelievo o il controllo con il microscopio a contrasto di fase al fine di ridurre al minimo i campionamenti inadeguati o insufficienti (cosiddetta "cito-assistenza"). Nei casi in cui non sia praticabile questa collaborazione, se possibile sarà bene allestire almeno un paio di vetrini in ogni caso. Tali strisci vanno subito immersi in alcool etilico 95°, prima che si asciughino all'aria e mai fissati a fiamma. Nell' alcool 95° i vetrini con gli strisci debbono rimanere almeno mezz'ora, sino ad un giorno un giorno e mezzo, dopodiché vanno asciugati all'aria ed inviati al laboratorio anatomoistocitopatologico. Devono essere siglati bene. In alternativa all' alcool etilico 95° può essere usato (sempre sul vetrino" fresco") lo spray Citofix, o simili. Personalmente consigliamo quest'ultimo metodo invece dell'alcool. Quando il vetrino risulta poi disseccato può essere inviato al Laboratorio.
Lesioni alla tiroide: un caso di Agoaspirazione Eco
Per alcuni organi come ad esempio la tiroide è buona norma allestire alcuni vetrini non fissati ma lasciati ad asciugare all' aria. In questo caso la colorazione che verrà effettuata in laboratorio sarà il May Grunwald Giemsa. Questa colorazione, nata per lo studio dei preparati ematologici, è molto diffusa tra i cito-patologi per alcune piccole differenze rispetto al Papanicolaou che possono risultare utili nell'interpretazioni di alcune patologie e della valutazione del materiale di "fondo"che accompagna la componente cellulare. La differenza principale è che le cellule lasciate essiccare all'aria non sono coartate dai fissativi e pertanto alcune strutture 'citoplasmatiche (granuli metacromatici, microvacuoli, ecc) risultano meglio evidenti. Cellule particolarmente delicate come quelle della linea seminaIe o della serie linfoide risultano molto meglio conservate con questa metodica.
In ogni caso la scelta della colorazione è in genere lasciata alla preferenza e all'esperienza del patologo. A nostro avviso i linfonodi, il testicolo, il fegato, la tiroide, le ghiandole salivari sono organi che ben si prestano allo studio con questa colorazione. In tutti casi è sempre preferibile eseguire la doppia metodica di fissazione (in alcool e all'aria) per avere strisci che si integrano utilmente ai fini della interpretazione diagnostica citologica.
Ci sono margini di errore diagnostico?
In questi ultimi anni la diagnosi agoaspirativa della tiroide, sempre più associata alla guida eco-grafica e a varie indagini ormonali di laboratorio (T3,T4,TSH. calcitonina), ha contribuito a migliorare notevolmente le nostre conoscenze sulla natura dei noduli tiroidei prima di affrontare un eventuale intervento chirurgico. Se si effettua una metodica corretta i falsi negativi non superano il 5%.
Diagnosi citologiche dubbie o sospette riguardano reperti relativi a:
- adenoma atipico;
- adenoma trabecolare ialinizzante;
- carcinoma follicolare ben differenziato.
In citologia tiroidea l'accuratezza diagnostica dei noduli freddi dipende dal grado di esperienza del patologo (11).
Il carcinoma papillare (Fig. 23), il midollare (Fig. 24-25-26) e l 'anaplastico sono diagnosticabili in una altissima percentuale di casi sulla base delle sottoindicate atipie citologiche:
- irregolarità del contorno della membrana nucleare con presenza di profonde incisure ("nuclear grooves"),
- pseudoinclusioni nucleari,
- nucleolo voluminoso,
- granuli metacromatici intracitoplasmatici,
- positività alla calcitonina e/o alla tireoglobulina.
Anche l'aspetto dello sfondo dello striscio può dare utili indicazioni diagnostiche sulla natura del nodulo tiroideo:
- colloide densa a"corda sfilacciata " o a chewing gum;
- microcalcificazioni e corpi psammomatosi;
- eccesso di sangue;
- amiloide;
Molto importante è anche il pattern di aggregazione cellulare dei frustoli aspirati che possono assumere vario aspetto:
- a microfollicoli isolati,
- ad aggregati più voluminosi mono o pluristratificati, . poco coesivi con prevalenza di elementi dispersi di grandezza e forma variabile.
Anche organi di piccole dimensioni come le paratiroidi possono essere utilmente indagate con la citologia, se eseguita con guida ecografica. Tale metodica si attua in:
- soggetti affetti da iperparatiroidismo primario;
- quando il clinico ritiene necessario asportare una o più paratiroidi che vanno indagate e localizzate prima dell'intervento operatorio
La patologia paratiroidea è da attribuire nell'80-85% dei casi all'adenoma, nel 12-15% ad una iperplasia e solo nel 1-3% dei casi ad un carcinoma.
La citologia preoperatoria viene eseguita su lesioni clinicamente sospette con caratteri scintigrafici dubbi o in presenza di alterazioni ecografiche multiple in sede ectopica intra o extra tiroidea. Lo scopo principale della valutazione citologica della paratiroide è pertanto quello di confermare la sede su cui intervenire.
Per quanto riguarda la diagnosi differenziale con le cellule tiroidee (tiroide) o con i linfociti (linfonodo) è utile associare sempre l'indagine cito-immunoisochimica (Fig. 27-28). La diagnosi differenziale fra l'adenoma, l'iperplasia o il carcinoma è un problema anatomo-clinico e istologico che si porrà al momento dell'intervento chirurgico, non essendo la citologia in questo senso sufficientemente attendibile (12).
Lesioni al fegato: un secondo caso di Agoaspirazione Eco
Un organo che ben si presta allo studio citologico mediante FNAB è il fegato. Le lesioni bersaglio vengono in genere individuate con l'ecografia, o con la TAC o con la RMN. La guida più efficace per la manovra agoaspirativa è comunque l'ecografia poiché permette di seguire il tragitto dell'ago durante la manovra, controllando gli spostamenti dell' organo durante i piccoli movimenti respiratori. Gli aghi che vengono usati a tale scopo sono aghi particolari, visibili con l’ecografia e muniti di mandrino.
Come funziona?
Dopo che l'ecografista ha individuato l'area ecograficamente sospetta, individua la traiettoria che l'ago percorrerà e la distanza della lesione dalla cute. A questo punto, con l'aiuto del patologo, inserirà l'ago sottile per via transcutanea (senza previa anestesia locale). Dopo che è stata controllata eco graficamente la posizione della punta dell' ago, viene estratto il mandrino e praticata l'agoaspirazione. In questo modo si evitano contaminazioni del materiale raccolto con gli altri tessuti attraversati dall'ago. La manovra dura complessivamente circa venti secondi durante i quali si invita il paziente a trattenere il respiro. L'agoaspirazione epatica ha come scopo essenziale la valutazione di lesioni neoplastiche, primitive o secondarie, benigne o maligne.
Vi si possono sottoporre tutti?
È importante che il patologo conosca esattamente l'anamnesi del paziente, così come tutte le notizie che possano essergli utili per l'esatto inquadramento della lesione epatica. Queste notizie condizioneranno eventualmente anche la scelta della colorazione che egli adotterà in quella circostanza.
Ci sono margini di errore diagnostico?
Sulla base morfologica è possibile diagnosticare con sufficiente certezza la maggior parte delle metastasi epatiche, così come gli epatocarcinomi. Più difficile è la diagnosi differenziale fra colangiocarcinoma e metastasi di adenocarcinoma. Abbastanza agevole è la diagnosi di epatocarcinoma moderatamente e scarsamente differenziato mentre per gli epatocarcinomi ben differenziati occorre attenersi ad alcuni criteri importanti di diagnosi differenziale con gli adenomi, le iperplasie nodulari focali ed i noduli rigenerativi della cirrosi (Fig. 19-22).
Epatocarcinoma ben differenziato
Possiamo essere sufficientemente certi della diagnosi di epatocarcinoma ben differenziato quando troviamo nel preparato i seguenti caratteri:
- alta cellularità,
- arrangiamento degli epatociti in trabecole caricaturali o in pseudoghiandole,
- monomorfismo cellulare,
- rapporto N/C sfavorevole,
- macronucleoli.
I caratteri sopraelencati sono necessari e da soli sufficienti per porre la diagnosi di epatocarcinoma. Vi sono altri caratteri, che possiamo definire secondari, che non sono sempre presenti e da soli non sono diagnostici di epatocarcinoma. Questi sono:
- i trombi biliari;
- le strutture papillari circondate da cellule di Kupffer;
- i nuclei nudi;
- le pseudoinclusioni nucleari
Lesioni al testicolo: un terzo caso di Agoaspirazione Eco
La citodiagnostica agoaspirativa del testicolo è una metodica semplice, priva di complicanze e utile per ottenere rapide informazioni circa la natura benigna o maligna di masse palpabili o ecograficamente rilevabili (13). Tuttavia la gran parte degli urologi è ancora riluttante nell' applicare la FNAB ai noduli del testicolo poiché ritiene sufficiente la valutazione clinica per decidere sulla necessità di una esplorazione chirurgica che termina quasi sempre con l'orchiectomia. Il motivo che frena l'urologo nell'uso della FNAB testicolare è il timore di un' estensione della neoplasia alla cute dello scroto.
Quali benefici posso trarre?
Particolarmente importante per la semplicità di esecuzione e la completa assenza di complicanze è lo studio cito logico del testicolo nell'identificazione delle cause di infertilità maschile da criptospermia, astenospermia o scarso numero di spermatozoi. La valutazione citologica delle varie cellule del tubulo seminifero è semplice ed è possibile ottenere dati sul rapporto fra le varie cellule della linea seminale, spermatogoni, spermatociti di I e II ordine, spermatidi, spermatozoi. È così possibile diagnosticare "blocchi escretori" da ostruzione congenita e/o acquisita delle vie di deflusso o dare indicazioni sul grado di arresto maturativo o di ipospermatogenesi per un'eventuale terapia ormonale (Fig. 29-30).
I vantaggi che derivano dalla FNAB del testicolo possono essere così riassunti:
- determinazione della spermatogenesi nell'infertilità . identificazione di neoplasie iniziali;
- indicazioni per la scelta di intervento chirurgico;
- diagnosi di processo infiammatorio;
- diagnosi di neoplasia che richieda un intervento chirurgico immediato (malignità) o differita (benignità).
- suggerimento per la ricerca di markers tumorali (HCG, APP, CEA).
Citologia ginecologica
1. È ormai nota da tempo l'utilità del prelievo citologico nell'ambito della ginecologia. Il prelievo citologico cervico-vaginale (Pap-test) è divenuto il metodo di screening più diffuso per la diagnosi precoce delle lesioni precancerose e neoplastiche del tratto genitale femminile. Oltre al suo utilizzo in ambito oncologico, ricordiamo il suo valore nella determinazione dello stato ormonale in diverse situazioni.
2. Il prelievo citologico si esegue prelevando materiale dalla endocervice, dalla esocervice e dal fornice vaginaIe laterale. 
Come funziona?
Per il prelievo si usa la spatola di Ayre ed un bastoncino cotonato od un cytobrush per la endocervice. Il materiale si striscia su un vetrino con estremità smerigliata, sulla quale è stato preventivamente segnato il cognome e nome della paziente, mantenendo separati i tre settori. Alcuni ginecologi utilizzano un vetrino differente per il prelievo endocervicale, così da dare più spazio alla valutazione della giunzione squamo-colonnare che è la zona di insorgenza della più gran parte dei carcinomi squamosi.
Subito dopo che il materiale è stato strisciato si provvede alla fissazione tramite immersione in alcool o con l'uso di fissativi a getto.
Quando un prelievo è considerato inadeguato?
Uno striscio è considerato inadeguato quando:
- è assente materiale della zona squamo-colonnare;
- per eccesso di citolisi, di cellule infiammatorie o di sangue;
- per scarsa cellularità (valutata al Papnet a meno del 35%).
Le ragioni tecniche per un campionamento inadeguato possono derivare da:
- prelievo in fase mestruale;
- contaminazione con creme vaginali (spermicidi, lubrificanti per ecografie, ecc.);
- prelievi troppo spessi o mal fissati;
- striscio lasciato seccare prima della fissazione.
Papilloma Virus: come ha cambiato le tecniche di diagnosi
Con la determinazione del ruolo cancerogeno dello Human Papilloma virus (HPV), anche la refertazione del Pap-test è radicalmente cambiata nel tempo.
Si è passati dal concetto di Displasia (lieve, media e grave) a quello di Neoplasia Intraepiteliale Cervicale (CIN 1,2,3), riconoscendo a tutti i gradi di displasia un potenziale valore neoplastico. Più recentemente, si è adottata la terminologia "Lesione Squamosa Intraepiteliale" ( SIL) che prevede due sole categorie: basso ed alto grado, attribuendo però sicuro valore neoplastico solo al SIL di alto grado secondo il sistema Bethesda (Fig. 31-40). Infatti, l'identificazione di numerosi sottotipi di HPV con potenzialità oncogene differenti, a basso rischio (HPV tipo 6-11) o ad alto rischio (HPV tipo 16-18) ha modificato l'interpretazione attribuita al SIL di basso grado che assume valore preneoplastico solo se associato a HPV ad alto rischio. Per questo motivo la corrispondenza tra tipi di HPV e SIL può essere controllata in singoli casi clinici mediante metodi di biologia molecolare effettuati su prelievi freschi o su materiale di archivio citologico e/o istologico.
Perché è importante questo cambiamento?
È interessante notare che il Bethesda (BTS):
- introduce alcuni concetti nuovi, primo fra tutti la valutazione dell'adeguatezza del materiale da parte del patologo;
- inserisce il Pap-test in una delle seguenti tre categorie: entro i limiti di norma, con alterazioni cellulari benigne, con anomalie di cellule epiteliali squamose o ghiandolari;
- introduce la voce “cellule squamose atipiche” di significato indeterminato (ASCUS).
Questa categoria facilita la classificazione di alcune atipie cellulari non ancora inquadrabili come displasia. E’ opportuno precisare che, a fronte degli evidenti benefici, questa categoria rischia di diventare recipiente di incertezze (7).
Citologia endometriale: un caso di citologia non di screening
La citologia endometriale è una citologia non di screening che viene eseguita su donne a rischio o sintomatiche ed in queste ultime necessita della conferma istologica su prelievo bioptico.
Per il campionamento diretto dell'endometrio vengono utilizzate diverse sonde fra cui ricordiamo:
- l'Endocyte di vario calibro;
- la MI-Mark elice;
- l'Endopap;
- la sonda di Novak per prelievi istologici
I metodi di valutazione citologica dell'endometrio sono:
- Pap-test;
- Strisci di campionamento endometriale diretto;
- "CelI block" di materiale endocavitario per esame dell'incluso.
I criteri diagnostici per la diagnosi citologica su strisci dell'endometrio sono:
- architettura dei lembi epiteliali (clusters ghiandolari di dimensioni variabili, tubuli di forma irregolare, presenza di papille e strutture arborescenti);
- diatesi tumorale rappresentata da segni di infiammazione e necrosi (aggregati di granulociti-istiociti ed epiteli disfatti, nuclei chiarificati, con membrana nucleare ispessita, macronucleoli, sfondo ematico con detriti cellulari);
- caratteristiche delle cellule stromali (cellule superficiali dello stroma endometriale a fisionomia simil-istiocitaria e cellule simil-fibrocitarie profonde);
- atipie, pluristratificazione, mitosi e necrosi degli epiteli ghiandolari;
- correlazioni clinico-citologiche (età, ultima mestruazione, uso di ormoni, IOD, pregressa revisione strumentale)
Perché sottoporsi a citologia endometriale?
La citologia endometriale sta assumendo recentemente una maggiore importanza in relazione al significativo aumento del carcinoma endometriale aIe dopo i 45 anni a causa di una maggiore longevità della donna, all'uso di estrogeni in epoca perimenopausale e postmenopausale, specie se a rischio (diabete, obesità, ipertensione, familiarità, ecc.).
Lo scopo principale è quello di riconoscere e curare le iperplasie endometriali correlate alla forma più comune di carcinoma dell' endometrio quale il carcinoma endometrioide.
Ci sono margini di errore diagnostici?
I più frequenti problemi diagnostici in citologia endometriale ("pitfalls") derivano dalla seguenti condizioni patologiche:
- "atipie" cellulari (AGOS) reattive a endometrite tbc e/o post-curettage ;
- clusters di adenocarcinoma ben differenziato con scarse atipie;
- aggregati papillari in endometrio follicolinico;
- adenocarcinoma endometrioide endocervicale;
- metastasi endometriale di adenocarcinoma extra uterino;
- atipie di cellule stromali che simulano un linfoma
Assai utile si è dimostrato lo studio interattivo con il Papnet per la possibilità di comparare contemporaneamente sullo schermo i campi selezionati nello striscio con gli aggregati ghiandolari o simil ghiandolari individuati dalla scansione automatica (lO).
In linea di massima, la citologia endometriale ha limiti maggiori di quella cervicale e viene generalmente considerata di valore diagnostico non definitivo. Per la necessità clinica di una precoce valutazione clinico-citologica del carcinoma endometrioide e dei suoi precursori, il ginecologo tende sempre più a ricorrere alla semplice citologia per innegabili vantaggi di costo, di tempo e di minor disturbo per le pazienti. Certamente, un citopatologo esperto può riconoscere agevolmente gli aspetti isto-funzionali determinati dagli ormoni follicolinico e luteinico, le modificazioni indotte dalla iperplasia semplice o atipica e l'adenocarcinoma (Fig. 41-44). Tuttavia, sussistono alcune difficoltà interpretative della citologia endometriale, specie in assenza di adeguate notizie cliniche o di una agevole consultazione con il ginecologo.
Per questi motivi il patologo ritiene in genere più affidabile il reperto istologico.
Biologia molecolare e citologia diagnostica
1. La trasformazione neoplastica si ritiene sia dovuta ad alterazioni di geni oncogeni e geni oncosoppressori che intervengono nel regolare le varie fasi della progressione di lesioni precancerose. Nelle neoplasie della cervice uterina l'alterazione dei geni cellulari si verifica spesso dall'interazione del DNA della cellula con il DNA di agenti virali (HPV, HSV II). Si riconoscono peraltro numerosi tipi sierologici di HPV e di questi solo alcuni (HPV tipo 16,18,31,33,51) contribuiscono a favorire un disordine genico della cellula senza tuttavia determinare significative differenze morfologiche con gli altri tipi virali non oncogeni.
2. Al fine di indicare al clinico il rischio di tale progressione sono state utilizzate tecniche molecolari applicate a materiale citologico appena prelevato, opportunamente fissato o anche d'archivio (3).
3. L'applicazione delle tecniche di biologia molecolare allo studio dei tumori ha portato nuove conoscenze nel campo del processo neoplastico soprattutto nella valutazione di quelle mutazioni (alterazioni anche puntiformi del DNA o perdite di eterozigosi in geni) che intervengono nelle prime fasi dell'alterazione cellulare. Il riconoscere queste alterazioni cellulari è un importante riferimento per la prognosi e quindi anche per la terapia che il clinico dovrà mettere in atto in questa fase molto precoce della progressione neoplastica.
4 Le tecniche utilizzate a questo scopo sono:
- PCR (Polymerase Chain Reaction): altamente sensibile, richiede particolare attenzione di esecuzione per l’altissimo rischio di esecuzione;
- Ibridizzazione in situ: meno sensibile della PCR, ha il vantaggio di indicare il numero e il tipo di cellule che presentano l’acido nucelico in esame
Vengono particolarmente usate in soggetti con lesioni condilomatose persistenti, recidivanti, o particolarmente attive ad alto rischio per una progressione neoplastica (SIL di alto grado).
Questi metodi si effettuano sempre più frequentemente in un moderno laboratorio di anatomia patologica per la facilità di applicazione ed a l'alta sensibilità diagnostica.
Quali sono le applicazioni diagnostiche della PCR?
Le applicazioni diagnostiche della PCR sono numerose e riguardano:
- l'accertamento nei tessuti e cellule del DNA anche di altri virus ( EBV, CMV, ecc), di batteri (micobatteri, helicobacter 'pylori, ecc.);
- la diagnosi di malattie genetiche ereditarie (distrofia muscolare di Erb-Duchenne, fibrosi cistica pancreatica, ecc.);
- la caratterizzazione di processi linfoproliferativi di significato incerto;
- l’identificazione di cloni neoplastici di cellule B o T ed infine in campo medico-legale.
Biopsie - estemporanee
1. Il Chirurgo moderno sa utilizzare sempre di più la collaborazione dell' anatomopatologo per la diagnosi istopatologica nel corso di interventi chirurgici. È questa la biopsia intraoperatoria, o peroperatoria, od estemporanea, o per congelamento, su cui si riesce a formulare la diagnosi in 5-10 minuti.
2. Compito dell'anatomopatologo è quello di applicare le necessarie metodiche con attrezzature adeguate per una rapida e attendibile diagnosi istologica.
3. Il medico richiedente e il personale presente in sala chirurgica devono attenersi alle seguenti raccomandazioni:
- il campione prelevato dal chirurgo, specialmente se di piccole dimensioni, va posto tra due garze imbevute di soluzione fisiologica e recapitato con urgenza in laboratorio;
- assieme al campione da esaminare va allegato il regolamentare modulo di richiesta, possibilmente con l'indicazione del quesito clinico e del numero telefonico della sala operatoria cui va data la risposta
Raccomandazioni fondamentali
L'anatomopatologo non può in alcun modo individuare, schedare ed eventualmente ri-reperire a distanza di tempo il paziente cui appartiene quel dato prelievo inviato dal medico, se questo non è accompagnato da un regolare modulo di richiesta d'esame. 
Per sottolineare quali siano gli elementi utili all' anatomopatologo viene più oltre riprodotto il facsimile di uno di tali moduli.
Attenzione! La compilazione del modulo è l'operazione in cui più spesso si commettono errori per distratta lettura di quanto richiesto a stampa o per imprecisa scrittura. Tenete presente che solo voi avete di fronte il paziente nella sua integrità e quindi la possibilità di portare avanti un accurato esame anamnestico.
Quando il vostro blocco di moduli sta per esaurirsi, organizzatevi per tempo a richiederne di nuovi!
Nel modulo riportato compaiono alcuni particolari di essenziale importanza.
- il cognome va tutto in stampatello mentre il nome deve essere scritto con la sola iniziale maiuscola. Esempio: ROSSI Armando, BRUNA Maria, etc…;
- è indispensabile l’ esatta indicazione del sesso non sempre deducibile dal nome;
- bisogna prestare particolare attenzione ai cognomi e ai nomi stranieri. Se possibile, chiedere al paziente una conferma;
- scrivere la data di nascita e mai l’età;
- assieme alla sede anatomica del prelievo siate sempre pr


